Chúng tôi giới thiệu Giải sách bài tập Hoá học lớp 12 Bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 12. Mời các bạn đón xem:
Bài giảng Hóa học 12 Bài 23: Luyện tập điều chế kim loại và sự ăn mòn hóa học
Giải SBT Hoá học 12 Bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại
Bài 23.1 trang 52 SBT Hoá học 12: Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3 và MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
A. Cu, Al, Mg.
B. Cu, Al, MgO.
C. Cu, Al2O3, Mg.
D. Cu, Al2O3, MgO.
Phương pháp giải:
CO khử được các oxit kim loại sau nhôm
Lời giải:
CO khử được CuO
=> Chọn D
Bài 23.2 trang 52 SBT Hoá học 12: Hòa tan 28 g Fe vào dung dịch AgNO3 dư đến khi phản ứng hoàn toàn thì khối lượng chất rắn thu được là
A.108g. B. 162 g.
C. 216 g. D. 154 g.
Phương pháp giải:
Viết phương trình hóa học và tính toán theo phương trình hóa học
Lời giải:
0,5 0,5 1
(1)
=> Chọn B
Bài 23.3 trang 52 SBT Hoá học 12: Điện phân 400 ml dung dịch CuSO4 0,2M với cường độ dòng điện 10A trong một thời gian thu được 0,224 lít khí (đktc) ở anot. Biết điện cực đã dùng là điện cực trơ và hiệu suất điện phân là 100%. Khối lượng catot tăng là
A. 1,28 g. B. 0,32 g.
C. 0,64 g. D. 3,2 g.
Phương pháp giải:
Tính số mol khí anot => Số mol Cu sinh ra
Lời giải:
(1)
- (2)
Từ (1), (2) đồng chưa điện phân hết.
=>
=>
=> Chọn A
Bài 23.4 trang 53 SBT Hoá học 12: Cuốn một sợi dây thép vào một thanh kim loại rồi nhúng vào dung dịch H2SO4 loãng. Quan sát thấy bọt khí thoát ra rất nhanh từ sợi dây thép. Thanh kim loại đã dùng có thể là
A. Cu. B. Ni.
C. Zn. D. Pt.
Lời giải:
Các cặp Fe và Pb, Fe và Sn, Fe và Ni. Sắt hoạt động hơn nên sẽ đóng vai trò là cực âm, bị phá huỷ trước
=>Chọn C
Bài 23.5 trang 53 SBT Hoá học 12: Ngâm một lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là
A. H2SO4. B. FeSO4.
C. NaOH. D. MgSO4.
Lời giải:
Khi cho FeSO4 vào dung dịch X xuất hiện pin điện hóa Fe - Zn và giảm sự tiếp xúc của hiđro trên bề mặt kim loại làm Zn ăn mòn nhanh hơn => khí thoát ra nhanh hơn
=> Chon B
Bài 23.6 trang 53 SBT Hoá học 12: Cắm 2 lá kim loại Zn và Cu nối với nhau bằng một sợi dây dẫn vào cốc thuỷ tinh. Rót dung dịch H2S04 loãng vào cốc thuỷ tinh đó thấy khí H2 thoát ra từ lá Cu. Giải thích nào sau đây không đúng với thí nghiệm trên ?
A. Cu đã tác dụng với H2SO4 sinh ra H2.
B. Ở cực dương xảy ra sự khử H+: 2H++ 2e —> H2 .
C. Ở cực âm xảy ra sự oxi hoá Zn : Zn —> Zn2+ + 2e.
D. Zn bị ăn mòn điện hoá và sinh ra dòng điện.
Lời giải:
Kim loại sau H trong dãy điện hóa không tác dụng với axit sunfuric loãng.
=> Chọn A
Bài 23.7 trang 53 SBT Hoá học 12: Để các hợp kim : Cu-Fe(1); Fe-C(2); Fe-Zn(3) trong không khí ẩm. Hợp kim trong đó sắt bị ăn mòn là
A. (1), (2). B. (2),(3).
C. (1),(3). D. (1),(2),(3)
Lời giải:
Tính kim loại Zn>Fe>Cu. Kim loại mạnh hơn sẽ bị ăn mòn trước => Fe-Cu thì sất bị ăn mòn trước
Fe-C trong đó sắt bị ăn mòn trước do
Cực âm
Cực dương
=> Chọn A
Bài 23.8 trang 53 SBT Hoá học 12: Trình bày phương pháp hoá học để có thể tách riêng từng kim loại ra khỏi một dung dịch có chứa các muối :
a) FeSO4 và CuSO4.
b) NaCl và CuCl2.
Phương pháp giải:
a) Cho sắt vào dung dịch thu được Cu sau đó thu được dung dịch FeSO4 => đưa về => dùng CO khử
b) Dùng NaOH => thu được dd NaCl điện phân nóng chảy thu được Na. Nung kết tủa => CuO dùng CO khử
Lời giải:
a)
b)
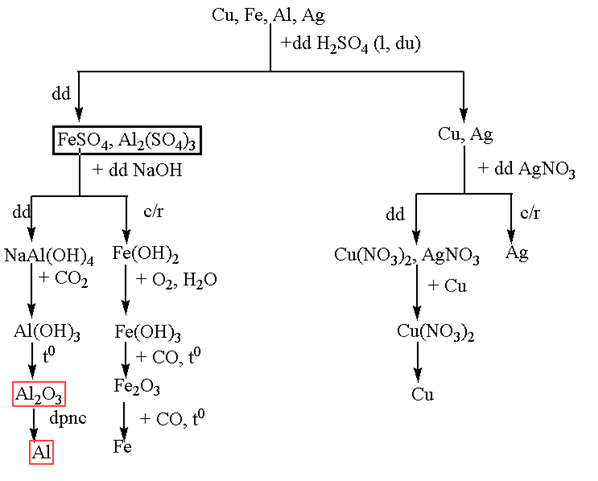
Bài 23.9 trang 53 SBT Hoá học 12: Trình bày sơ đồ tách riêng từng kim loại từ hỗn hợp các kim loại : Cu, Fe, Al, Ag.
Phương pháp giải:
- Dùng tách Fe, Al, và Cu, Ag thu được dung dịch X
- Dùng để tách Ag => Thêm Cu vào dung dịch thu được để thu được sau đó điện phân dung dịch
- Dùng NaOH dư vào dung dịch X thu được chất rắn và dung dịch Y
- dùng CO khử
- Thêm vào dung dịch Y thu được -> sau đó điện phân nóng chảy thu được Al
Lời giải:
Bài 23.10 trang 53 SBT Hoá học 12: Hoà tan hiđroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20% thu được dung dịch muối có nồng độ 27,21%. Xác định kim loại M.
Phương pháp giải:
- Gọi số mol M(OH)2 là x
- Tính ,
- Từ C% => M
Lời giải:
Ta có PTHH:
M(OH)2 + H2SO4 → MSO4 + 2H2
x → x → x
m ddH2SO4 =
⟹ mdd sau phản ứng = (M+34)x + 490x = (M + 524)x (gam)
Ta lại có: mMSO4 =(M + 96)x
⟹ C%MSO4=
⟺ M = 64 Vậy kim loại cần tìm là Cu.
Bài 23.11 trang 53 SBT Hoá học 12: Nhiệt phân hoàn toàn 9,4 gam một muối nitrat kim loại M hoá trị không đổi được 4 gam oxit và hỗn hợp khí NO2 và O2. Xác định công thức muối của kim loại M.
Phương pháp giải:
- Sau khi nhiệt phân thu được oxit kim loại nên loại AgNO3.
- Giả sử kim loại hóa trị II số mol x
- Viết phương trình hóa học, BTKL tính khối lượng khí => x => M của muối=> KL
Lời giải:
Vì sau khi nhiệt phân thu được oxit kim loại nên loại AgNO3.
Để đơn giản ta giả sử M có hoá trị II :
2M(NO3)2 ⟶ 2MO + 4NO2+ O2
x ⟶ 2x ⟶
Nhận thấy khối lượng chất rắn giảm bằng khối lượng khí thoát ra
⟹ mNO2 + mO2 = 9,4 - 4 = 5,4 g
⟶ 46.2x + 16x = 5,4 ⟶ x = 0,05
Vậy muối đó là Cu(NO3)2.

