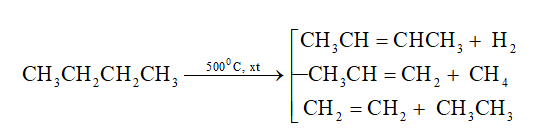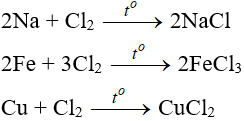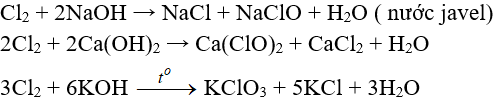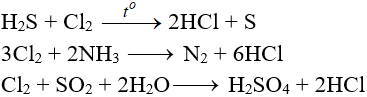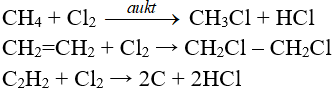Chúng tôi xin giới thiệu phương trình C4H10 + Cl2 → C4H9Cl + HCl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C4H10 + Cl2 → C4H9Cl + HCl
1. Phản ứng hóa học:
C4H10 + Cl2 → C4H9Cl + HCl
2. Điều kiện phản ứng
- Chiếu sáng hoặc đun nóng.
3. Cách thực hiện phản ứng
- Khi có ánh sáng, butan (C4H10) phản ứng với khí clo thu được butyl clorua (C4H9Cl) và khí hidro clorua (HCl).
4. Hiện tượng nhận biết phản ứng
- Trước khi chiếu sáng hoặc đun nóng, bình khí có màu vàng của clo. Sản phẩm sau phản ứng không có màu (Xét phản ứng xảy ra hoàn toàn và vừa đủ, không có chất dư).
5. Phản ứng hóa học
5.1. Phản ứng hóa học của Butan
- Trong phân tử C4H10 chỉ có liên kết và . Đó là các liên kết xích ma bền vững, vì thế C4H10 tương đối trơ về mặt hóa học: Ở nhiệt độ thường, chúng không phản ứng với axit, bazơ và chất oxi hóa mạnh (như KMnO4) Dưới tác dụng của ánh sáng, xúc tác, nhiệt, C4H10 tham gia các phản ứng thế, phản ứng tách và phản ứng oxi hóa.
a. Phản ứng thế bởi halogen
- Khi chiếu sáng hoặc đốt nóng hỗn hợp butan và clo sẽ xảy ra phản ứng thế lần lượt các nguyên tử hidro bằng clo. Tương tự như metan.
C4H10 + Cl2 → C4H9Cl + HCl
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất halogen.
b. Phản ứng tách (gãy liên kết C-C và C-H)
- Dưới tác dụng của nhiệt và xúc tác (Cr2O3, Fe, Pt,...), các ankan không những bị tách hidro tạo thành các hidrocacbon không no mà còn bị gãy các liên kết C-C tạo ra các phân tử nhỏ hơn.
c. Phản ứng oxi hóa
- Khi đốt, butan bị cháy tạo ra CO2, H2O và tỏa nhiều nhiệt
- Nếu không đủ oxi, ankan bị cháy không hoàn toàn, khi đó ngoài CO2 và H2O còn tạo ra các sản phẩm như CO, than muội, không những làm giảm năng suất tỏa nhiệt mà còn gây độc hại cho môi trường.
5.2. Tính chất hóa học của Clo
a. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
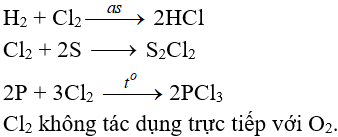
b. Tác dụng với phim kim
(cần có nhiệt độ hoặc có ánh sáng)
c. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
- Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
- Tác dụng với dung dịch bazơ
d. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
e. Tác dụng với chất khử khác
f. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
6. Bạn có biết
- Phản ứng trên được gọi là phản ứng thế.
- Sản phẩm chính là sản phẩm ưu tiên thế H của C bậc cao (C có ít H hơn).
7. Bài tập liên quan
Ví dụ 1: Sản phẩm thu được khi cho butan(C4H10) phản ứng với clo (1:1) là?
A. Khí hidro cloruavà butyl clorua
B. Propyl clorua và metyl clorua
C. Khí hidro clorua và etyl clorua
D. Không phản ứng
Hướng dẫn:
Khi cho butan phản ứng với clo (1:1) thu được khí hidroclorua và butylclorua.
Đáp án A.
Ví dụ 2: Cho 5,8 gam C4H10 phản ứng với khí clo (vừa đủ theo tỉ lệ 1 : 1). Sau phản ứng thi được bao nhiêu lít khí?
A. 1,12 lít
B. 2,24 lít
C. 4,48 lít
D. 10,08 lít
Hướng dẫn:
Số mol C4H10: 0,1 mol
C4H10 + Cl2 → C4H9Cl + HCl
Khí sau phản ứng là HCl: 0,1 mol
Vkhí = 0,1.22,4 = 2,24 lít.
Đáp án C.
8. Một số phương trình phản ứng hoá học khác của Ankan và hợp chất: