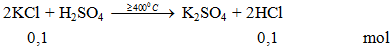Chúng tôi xin giới thiệu phương trình 2KCl + H2SO4 -≥400oC→ K2SO4 + 2HCl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình 2KCl + H2SO4 -≥400oC→ K2SO4 + 2HCl
1. Phương trình phản ứng hóa học:
2KCl + H2SO4 -≥400oC→ K2SO4 + 2HCl
2. Hiện tượng nhận biết phản ứng
- Có khí thoát ra.
3. Điều kiện phản ứng
≥ 4000C
4. Tính chất hóa học
– KCl là một muối trung hòa nó mang đầy đủ tính chất hóa học của muối.
– Phân ly toàn trong nước tạo thành các ion âm và ion dương:
KCL → K+ + Cl–
– Phản ứng với dung dịch chứa AgNO3
KCl + AgNO3 → AgCl ↓ + KNO3
– Kali Clorua là muối được tạo từ bazơ mạnh và axit mạnh nên nó mang tính trung tính; do đó tương đối trơ về mặt hóa học.
– Phản ứng với H2SO4 đặc để tạo ra K2SO4 và HCL
2KCl + H2SO4 đặc → K2SO4 + 2HCl
– Kali clorua được sử dụng làm nguyên liệu để điều chế kim loại kali trong công nghiệp (thay thế bằng kim loại natri ở nhiệt độ cao 850 ° C
KCL + Na → K + NaCl
5. Cách thực hiện phản ứng
- Cho tinh thể KCl tác dụng với H2SO4 đặc và đun nóng (≥ 4000C)
6. Bạn có biết
- Đây là phương pháp sunfat, dung điều chế HCl trong phòng thí nghiệm.
7. Bài tập liên quan
Ví dụ 1: Khí hidro clorua có thể được điều chế bằng cách cho KCl rắn tác dụng với chất nào sau đây?
A. H2SO4 loãng.
B. H2SO4 đặc.
C. NaOH.
D. H2O.
Hướng dẫn giải
Khí hidro clorua có thể được điều chế bằng cách cho KCl rắn tác dụng với H2SO4 đặc.
Đáp án B.
Ví dụ 2: Khi cho KCl phản ứng với H2SO4 đặc ở 4000C thu được sản phẩm muối là
A. K2SO4.
B. KHSO4.
C. K2SO3.
D. KHSO3.
Hướng dẫn giải
2KCl + H2SO4 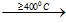
Đáp án A.
Ví dụ 3: Thể tích khí HCl ở đktc thu được khi cho 7,45 gam KCl phản ứng với H2SO4 đặc ở 4000C là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 4: Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 loãng?
A. Al, Mg, Ag
B. Fe, Mg, Ag
C. Al, Fe, Zn
D. Al, Fe, Cu
Đáp án C
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là Al, Fe, Mg
Loại A vì Cu không phản ứng
Loại B vì Ag không phản ứng
Loại D vì Cu không phản ứng
Ví dụ 5: Phương trình hóa học nào sau đây không đúng?
A. Cu + 2H2SO4 (đặc) → CuSO4 + SO2+ 2H2O
B. Fe + S → FeS
C. Cu + AgNO3 → Ag + Cu(NO3)2
D. 2Fe + 3H2SO4 (loãng) → Fe2(SO4)3 + 3H2
Đáp án D
Ví dụ 6: Kim loại nào sau đây không phản ứng với H2SO4 loãng
A. Fe
B. Zn
C. Cu
D. Mg
Đáp án C
Ví dụ 7: Cho 2,4 gam kim loại M hóa trị II tác dụng H2SO4 sau phản ứng thu được 0,1 mol khí H2. Kim loại M là:
A. Zn
B. Fe
C. Mg
D. Cu
Đáp án C
Ví dụ 8: Những tính chất sau, tính chất nào không phải tính chất của khí hiđroclorua?
A. Tan nhiều trong nước.
B. Tác dụng với khí NH3.
C. Tác dụng với CaCO3 giải phóng khí CO2.
D. Làm đổi màu giấy quỳ tím ẩm.
Đáp án B
Ví dụ 9: Chỉ ra đâu không phải là đặc điểm chung của tất cả các halogen?
A. Nguyên tử halogen dễ thu thêm 1 electron.
B. Các nguyên tố halogen đều có khả năng thể hiện các số oxi hóa -1, +1, +3, +5, +7.
C. Halogen là những phi kim điển hình.
D. Liên kết trong phân tử halogen X2 không bền lắm, chúng dễ bị tách thành 2 nguyên tử halogen X.
Đáp án B
Ví dụ 10: Phản ứng dùng để điều chế HCl trong phòng thí nghiệm là:
A. H2 + Cl2 → HCl.
B. AgNO3 + HCl → AgCl + HNO3
C. NaCl(r) + H2SO4 (đ) → NaHSO4+ HCl.
D. BaCl2 + H2SO4→ BaSO4 + HCl.
Đáp án C
Ví dụ 11: Đặc điểm nào không phải là đặc điểm chung của các halogen
A. Tác dụng với hầu hết các kim loại và phi kim
B. Đều có tính oxi hóa mạnh
C. Đều là chất khí ở điều kiện thường
D. Khả năng tác dụng với nước giảm dần từ F2 đến I2
Đáp án C
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
2KI + O3 + H2O → 2KOH + I2 + O2
2KI + 2FeCl3 → I2 + 2FeCl2 + 2KCl