Chúng tôi xin giới thiệu phương trình 6KOH + 3Cl2 -90oC→ 5KCl + KClO3 + 3H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình 6KOH + 3Cl2 -90oC→ 5KCl + KClO3 + 3H2O
1. Phương trình phản ứng hóa học:
6KOH + 3Cl2 -90oC→ 5KCl + KClO3 + 3H2O
2. Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ có màu xanh, sau khi phản ứng xảy ra màu xanh của quỳ bị mất.
3. Điều kiện phản ứng
- Phản ứng xảy ra ở khoảng 900C.
4. Tính chất hóa học
- KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
Ở điều kiện nhiệt độ phòng, KOH tác dụng với oxit axit như SO2, CO2
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
- KOH tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
- KOH tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
- KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới
KOH + Na → NaOH + K
- KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
- KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion Na+ và OH-
Phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
- KOH phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
5. Cách thực hiện phản ứng
- Dẫn khí Cl2 vào ống nghiệm chứa dung dịch KOH đun nóng và mẩu quỳ tím.
6. Bạn có biết
- Tương tự KOH, Clo có thể phản ứng với các dung dịch kiềm ở nhiệt độ cao cho muối clorat.
7. Bài tập liên quan
Ví dụ 1: KOH không thể phản ứng với khí nào sau?
B. SO2.
B. CO2.
C. Cl2.
D. H2.
Hướng dẫn giải
KOH không thể phản ứng với H2.
Đáp án D.
Ví dụ 2: Cho Clo phản ứng vừa đủ với KOH ở 900C, sản phẩm thu được có chứa các chất nào?
A. KCl và KClO.
B. KCl và KClO3.
C. KClO.
D. KCl.
Hướng dẫn giải
6KOH + 3Cl2 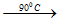
Đáp án B.
Ví dụ 3: Thể tích khí Clo ở đktc cần dùng để phản ứng vừa đủ với 100ml KOH 1M ở 900C là
B. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
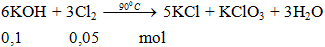
V = 0,05.22,4 =1,12 lít.
Đáp án A.
Ví dụ 4: Sục khí Clo vào lượng dung dịch NaOH ở nhiệt độ thường sản phẩm là
A. NaCl, NaClO2
B. NaCl, NaClO3
C. NaCl, NaClO
D. chỉ có NaCl
Đáp án C
Phương trình hóa học xảy ra:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Vậy sản phẩm thu được có NaCl, NaClO.
Ví dụ 5: Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư thu được dung dịch chứa các chất tan thuộc dãy nào sau đây?
A. KCl, KClO3, Cl2
B. KCl, KClO, KOH
C. KCl, KClO3, KOH
D. KCl, KClO3
Đáp án C
Hướng dẫn giải
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Ví dụ 6: Cho phản ứng:
Cl2 + KOH → KCl + KClO3 + H2O. Tỉ lệ giữa số nguyên clo đóng vai trò chất oxi hóa và số nguyên tử clo đóng vai trò chất khử trong phương trình hóa học trên là:
A. 1 : 3.
B. 3 : 1.
C. 5 : 1.
D. 1 : 5.
Đáp án C
Ví dụ 7: Kim loại tác dụng với dung dịch HCl và tác dụng với khí Cl2 đều cho cùng một muối là
A. Fe
B. Mg
C. Cu
D. Ag
Đáp án B
Hướng dẫn giải
Loại Cu và Ag vì Cu, Ag đều không tác dụng với HCl.
Loại Fe vì phản ứng HCl → FeCl2 và phản ứng với Cl2 → FeCl3.
Fe + 2HCl → FeCl2
2Fe + 3Cl2→ 2FeCl3
Vậy chỉ có Mg tác dụng với HCl và Cl2 cho cùng 1 muối MgCl2
Mg + 2HCl → MgCl2
Mg + Cl2 → MgCl2
Ví dụ 8: Công dụng nào sau đây không phải của NaCl?
A. Làm thức ăn cho người và gia súc
B. Làm dịch truyền trong y tế
C. Điều chế Cl2, HCl, Nước Javen
D. Khử chua cho đất
Đáp án D
Ví dụ 9: Dãy các muối nào sau đây tan trong nước?
A. KCl, KNO3, BaSO4, KMnO4.
B. Al2(SO4)3, AgCl, Na2CO3, CaCl2.
C. BaCO3, FeCl3, K2SO4, NaNO3.
D. FeSO4, AlCl3, NaNO3, NH4Cl.
Đáp án D
Ví dụ 10: Khi sục khí clo vào dung dịch NaOH ở điều kiện thường được dung dịch X. Lấy một mảnh vài nhỏ có màu đỏ cho vào dung dịch X. Sau một thời gian lấy ra, thấy hiện tượng
A. màu của mảnh vải vẫn không thay đổi
B. màu của mảnh vải bị nhạt đi hẳn
C. màu của mảnh vải chuyển sang màu vàng
D. màu của mảnh vải chuyển sang màu tím
Đáp án B
Hướng dẫn giải
Màu của mảnh vải bị nhạt đi hẳn
Do xảy ra phản ứng:
2NaOH + Cl2 → NaCl + NaClO + H2O2
NaClO trong dung dịch mới tạo ra có tính tẩy màu mạnh, nên làm mất màu của quỳ tím.
Ví dụ 11: Trong phản ứng clo với nước, clo là chất:
A. oxi hóa.
B. khử.
C. vừa oxi hóa, vừa khử.
D. không oxi hóa, khử.
Đáp án C
Ví dụ 12: Hãy lựa chọn phương pháp điều chế khí hidroclorua trong phòng thí nghiệm:
A. Thủy phân AlCl3.
B. Tổng hợp từ H2 và Cl2.
C. Clo tác dụng với H2O.
D. NaCl tinh thể và H2SO4 đặc.
Đáp án D
Ví dụ 13: Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
A. HF, HCl, HBr, HI.
B. HF, HCl, HBr và một phần HI
C. HF, HCl, HBr.
D. HF, HCl.
Đáp án D
Hướng dẫn giải
2NaF + H2SO4 → Na2SO4 + 2HF
2NaCl + H2SO4→ Na2SO4 + 2HCl
2NaBr + 2H2SO4 → Na2SO4 + Br2 + SO2 + 2H2O
8NaI + 5H2SO4 → 4Na2SO4 + 4I2 + H2S + 4H2O
Ví dụ 14: Nhận định nào sau đây không đúng?
A. HI và I2 đều làm hồ tinh bột hóa xanh.
B. Nước clo có thể làm mất màu quỳ tím.
C. Nước clo, nước Gia-ven và clorua vôi đều có tính sát trùng và tẩy màu.
D. Brom dễ tan trong dung môi hữu cơ.
Đáp án A
Ví dụ 15: Để loại bỏ khí clo dư người ta sục vào dung dịch nào sau đây?
A. Dung dịch HCl.
B. Dung dịch NaOH.
C. Dung dịch NaCl.
D. Nước.
Đáp án B
Ví dụ 16: Trong phòng thí nghiệm clo được điều chế bằng cách cho HCl đặc phản ứng với
điều chế Cl2. Chất dùng để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc.
B. Na2SO3 khan.
C. CaO.
D. dung dịch NaOH đặc.
Đáp án A
7. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:

