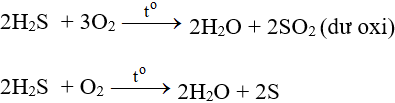Chúng tôi xin giới thiệu phương trình H2S + Pb(NO3)2 → PbS + HNO3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình H2S + Pb(NO3)2 → PbS + HNO3
1. Phương trình phản ứng hóa học
H2S + Pb(NO3)2 → PbS + 2HNO3
2. Hiện tượng nhận biết phản ứng.
- Hiện tượng quan sát được là có kết tủa màu đen (PbS) xuất hiện.
3. Điều kiện phản ứng
- Nhiệt độ thường
4. Tính chất hóa học
4.1. Tính chất hóa học của Pb(NO3)2
- Mang tính chất hóa học của muối
Dễ bị phân hủy
2 Pb(NO3)2 
Tác dụng với dung dịch bazo
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3
Pb(NO3)2 + Ba(OH)2 → Pb(OH)2 + Ba(NO3)2
Tác dụng với axit
H2S + Pb(NO3)2 → HNO3 + PbS
Tác dụng với muối
Pb(NO3)2 + K2S → PbS + 2KNO3
4.2. Tính chất hóa học của H2S
a. Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
b. Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
5. Cách thực hiện phản ứng
- Dẫn khí H2S vào dung dịch muối Pb(NO3)2
6. Bạn có biết
- Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
7. Bài tập liên quan
Câu 1. Sục khí H2S vào dung dịch muối Pb(NO3)2, hiện tượng quan sát được là
A. dung dịch có kết tủa màu xanh lam
B. có kết tủa màu vàng.
C. có kết tủa màu đen.
D. có kết tủa màu trắng xanh
Đáp án C
Phương trình phản ứng hóa học
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
đen
Vậy hiện tượng quan sát được là có kết tủa màu đen (PbS) xuất hiện.
Câu 2. Cho các thí nghiệm sau
(1) Thả Ba vào dung dịch chứa phèn chua [KAl(SO4)2.12H2O]
(2) Cho dung dịch FeSO4phản ứng với dung dịch AgNO3
(3) Sục khí H2S vào dung dịch muối Pb(NO3)2
(4) Sục khí NH3 vào dung dịch hỗn hợp CuCl2 và AlCl3
(5) Cho một miếng Al vào dung dịch KOH dư rồi sục khí CO2 vào
Tổng số thí nghiệm có khả năng tạo kết tủa là:
A. 2
B. 4
C. 3
D. 5
Đáp án D
(1) Tạo kết tủa BaSO4 có thể có thêm Al(OH)3
Ba + 2H2O → Ba(OH)2 + H2↑
Ba2+ + SO42- → BaSO4↓ + H2O
Al3+ + 3OH- → Al(OH)3↓
(2) tạo kết tủa AgCl và Ag
FeSO4 + 2AgNO3 → Ag2SO4↓ + Fe(NO3)2
Fe(NO3)2 + AgNO3→ Ag↓ + Fe(NO3)3
(3) tạo kết tủa PbS
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
có kết tủa màu đen (PbS) xuất hiện.
(4) Tạo kết tủa trắng Al(OH)3 có thể có thêm kết tủa xanh lam Cu(OH)2
NH3 + H2O + AlCl3 → Al(OH)3↓ + NH4Cl
NH3 + H2O + CuCl2→ Cu(OH)2↓ + NH4Cl
4NH3 + Cu(OH)2 → Cu(NH3)4(OH)2 phức tan
(5) tạo kết tủa Al(OH)3 không tan trong CO2
Al + KOH + H2O → KAlO2+ 3/2H2↑
Câu 3. Cho các chất sau: KHCO3, KNO3, NH4Cl, I2, Na2CO3, Fe, Fe(OH)3 và FeS2. Có bao nhiêu chất trong các chất cho sau đây mà khi nung trong không khí đến khối lượng không đổi thu được chất rắn mới có khối lượng nhỏ hơn chất rắn ban đầu
A. 4.
B. 6.
C. 3.
D. 5.
Đáp án A
Để có khối lượng chất rắn nhỏ hơn chất ban đầu thì: Các chất có phản ứng tạo ra chất mới ở thể rắn và khí
Đặt số mol mỗi chất đem nung là a mol
Các chất khi nhiệt phân thu được rắn có khối lượng nhỏ hơn là: NaHCO3, NaNO3, Fe(OH)3, FeS2
2KHCO3 ⟶ Na2CO3 + CO2↑ + H2O
2KNO3⟶ 2NaNO2+ O2
2Fe(OH)3 ⟶ Fe2O3 + 3H2O
4FeS2+ 11O2⟶ 2Fe2O3 + 8SO2
Câu 4. Cho các lọ hóa chất riêng rẽ bị mất nhãn sau: Pb(NO3)2, FeCl3, NaOH, MnCl2, NaCl. Chỉ dùng dung dịch H2S, có thể nhận biết tối đa được mấy chất.
A. 3
B. 4.
C. 5
D. 6
Đáp án A
Chỉ dùng dung dịch H2S, có thể nhận biết tối đa được 3 chất là: Pb(NO3)2, MnCl2, FeCl3
Ta có các phương trình phản ứng lần lượt theo thứ tự là:
H2S + Pb(NO3)2 → PbS ↓ (màu đen) + 2HNO3
H2S tác dụng với Pb(NO3)2 sinh ra PbS có kết tủa màu đen
MnCl2 + H2S → MnS + 2HCl
H2S tác dụng với MnCl2 sinh ra MnS có kết tủa màu hồng
H2S + 2FeCl3 → S↓(vàng) + 2FeCl2 + 2HCl
Màu vàng nâu của dung dịch Sắt III clorua (FeCl3) nhạt dần và xuất hiện kết tủa vàng Lưu huỳnh (S)
Câu 5. Có 4 lọ, mỗi lọ đựng một dung dịch không màu: KCl, HCl, K2SO4, Ba(NO3)2. Chỉ sử dụng một hóa chất duy nhất để nhận biết 4 dung dịch mất nhãn trên. Hóa chất đó là:
A. dung dịch HCl
B. Dung dịch H2SO4
C. Dung dịch NaOH
D. Dung dịch AgNO3
Đáp án A
Trích mỗi dung dịch một ít làm mẫu thử, cho quỳ tím lần lượt vào các mẫu thử, mẫu thử nào quỳ tím hóa đỏ là HCl.
Cho vài giọt dung dịch BaCl2 vào 3 mẫu thử cón lại, mẫu thử nào tạo kết tủa trắng là ống nghiệm đựng K2SO4.
K2SO4 + BaCl2 → KCl + BaSO4↓
Cho vài giọt dung dịch K2SO4 (đã biết) vào 2 mẫu thử còn lại, mẫu nào có kết tủa trắng là dung dịch Ba(NO3)2
K2SO4 + Ba(NO3)2 → 2KNO3 + BaSO4↓
Còn lại dung dịch KCl, có thể khẳng định bằng dung dịch AgNO3
AgNO3 + KCl → AgCl↓ + KNO3
8. Một số phương trình phản ứng hoá học khác của Chì (Pb) và hợp chất:
H2S + Pb(NO3)2 → PbS ↓ + HNO3