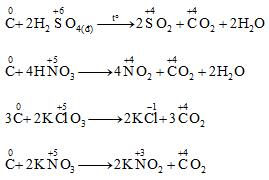Chúng tôi xin giới thiệu phương trình Fe3O4 + CO → 3FeO + CO2↑ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình Fe3O4 + CO → 3FeO + CO2↑
1. Phương trình phản ứng hóa học:
Fe3O4 + CO → 3FeO + CO2↑
2. Hiện tượng nhận biết phản ứng.
- Phản ứng có thoát ra khí CO2
3. Điều kiện phản ứng
- Nhiệt độ: 500 - 600oC
Đây cũng là một trong các phản ứng hóa học xảy ra trong quá trình luyện quặng thành gang
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của Fe3O4 (Oxit sắt từ)
- Trong phản ứng trên Fe3O4 là chất oxi hoá.
- Fe3O4 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al, ...
b. Bản chất của CO (Cacbon oxit)
- Trong phản ứng trên CO là chất khử.
- CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hoá học của kim loại với điều kiện nhiệt độ cao.
5. Tính chất hóa học
5.1. Tính chất hóa học của Fe3O4
- Tính oxit bazơ
Fe3O4 tác dụng với dung dịch axit như HCl, H2SO4loãng tạo ra hỗn hợp muối sắt (II) và sắt (III).
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 loãng→ Fe2(SO4)3 + FeSO4 + 4H2O
- Tính khử
Fe3O4 là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
3 Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
- Tính oxi hóa
Fe3O4 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
Fe3O4 + 4H2 → 3Fe + 4H2O
Fe3O4 + 4CO → 3Fe + 4CO2
3Fe3O4 + 8Al → 4Al2O3 + 9Fe
5.2. Tính chất hóa học của CO
- Độ hoạt động hóa học: kim cương < than chì < cacbon vô định hình
- CO là oxit trung tính
Ở điều kiện thường CO không phản ứng với nước, axit, bazơ.
- CO là chất khử
+ Ở nhiệt độ cao, CO khử được nhiều oxit kim loại, một số hợp chất có tính oxi hóa mạnh.
Phương trình hóa học: 4CO + Fe3O4 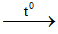
+ CO cháy trong khí oxi tỏa nhiều nhiệt.
Phương trình hóa học: 2CO + O2 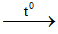
6. Cách thực hiện phản ứng
- Cho Fe3O4 tác dụng với khí CO ở nhiệt độ cao
7. Bạn có biết
- Ở nhiệt độ cao, CO có thể khử được nhiều oxit kim loại (CuO, Fe,2O3, ZnO,...)
8. Bài tập liên quan
Câu 1. Trong lò cao, sắt oxit có thể bị khử theo 3 phản ứng:
3Fe2O3 + CO → 2Fe3O4 + CO2 (1)
Fe3O4 + CO → 3FeO + CO2 (2)
FeO + CO → Fe + CO2 (3)
Ở nhiệt độ khoảng 700- 800oC, thì có thể xảy ra phản ứng
A. (1).
B. (2).
C. (3).
D. cả (1), (2) và (3).
Lời giải:
Câu 2. Trong các loại quặng sắt, quặng chứa hàm lượng % Fe lớn nhất là
A. Hematit đỏ
B. Hematit nâu
C. Manhetit
D. Xiđerit
Lời giải:
Câu 3. Khử hết m gam Fe3O4 bằng khí CO thu được hỗn hợp A gồm Fe và FeO. A tan vừa đủ trong 0,3 lít dung dịch H2SO4 1M cho ra 4,48 lít khí (đktc). Thể tích khí CO (đktc) đã phản ứng là? (Fe = 56, O=16)
A. 4,48 lít
B. 8,96 lít
C. 6,72 lít
D. 2,24 lít
Lời giải:
Fe + H2SO4 → FeSO4 + H2
FeO + H2SO4 → FeSO4 + H2O
=> nFe = nH2 = 0,2 mol
=> nFeO = 0,3 – 0,2 = 0,1 mol
Bảo toàn Fe: nFe + nFeO = 3nFe3O4
=> nFe3O4 = 0,1 mol
Bảo toàn O:
4nFe3O4+ nCO = 2nCO2 + nFeO
Vì nCO = nCO2
=> nCO = 4.0,1 – 0,1 = 0,3 mol
=> V = 6,72 lít
Câu 4. Quặng sắt nào dưới đây có thể dùng để điều chế axit sunfuric?
A. xiđerit
B. hematit
C. manhetit
D. pirit
Lời giải:
Câu 5. Thổi khí CO vào lò luyện thép phản ứng hóa học không xảy ra là:
A. O2 + Fe → 2FeO
B. C + O2 → CO2
C. FeO+ CO → Fe + CO2
D. FeO + Mn → Fe + MnO
Lời giải:
Câu 6. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe (III)?
A. HCl, HNO3 đặc nóng, H2SO4 đặc nóng
B. HCl, HNO3 loãng, H2SO4 đặc nguội
C. Cl2, H2SO4 đặc nóng, HCl đặc
D. Cl2, AgNO3, HNO3 loãng
Lời giải:
Câu 7. Những kim lọai nào sau đây đẩy được sắt ra khỏi dung dịch sắt (II) sunfat và bạc ra khỏi bạc Nitrat :
A. K, Mg, Zn
B. Mg, Zn, Al
C. Al, Cu, Ag
D. Fe, Zn, Pb
Lời giải:
Câu 8. Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat. Hiện tượng xảy ra là:
A. Không xuất hiện, hiện tượng gì cả.
B. Ag được giải phóng, nhưng Fe không biến đổi.
C. Không có chất nào sinh ra, chỉ có Fe bị hoà tan.
D. Fe bị hoà tan một phần, Ag được giải phóng.
Lời giải:
Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat xảy ra phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
=> Hiện tượng xảy ra là: sắt bị hòa tan một phần, bạc được giải phóng.
Câu 9. Cho 5,68 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 0,672 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 38,72
B. 35,50
C. 19,36
D. 34,36
Lời giải:
Cách 1.
Quy đổi hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 thành Fe và Fe2O3.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,03 → 0,03 → 0,03
⇒ nFe2O3 = = 0,025 mol
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,025 → 0,05
Vậy muối = (0,05 + 0,03). 242 = 19,36 (g)
*Cách 2:
Xem hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 chỉ gồm 2 nguyên tố Fe và O
Ta có sơ đồ: Fe: a mol; Fe(NO3)3: a mol
O: b mol
Ta có 56x + 16y = 5,68 (1)
Quá trình nhường electron:
Fe0 - 3e → Fe+3
a → 3a
Quá trình nhận electron:
O+0 + 2e → O-2
b → 2b
N+5 + 3e → N+2
0,09 0,03
Áp dụng định luật bảo toàn electron, ta có: 3a = 2b + 0,09 (2)
Từ (1) và (2) → x = 0,09 mol và y = 0,075 mol
⇒ mFe(NO3)3 = 0,08. 242 = 19,36 (g)
Câu 10. Nung nóng 25,2 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 8,4 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
A. 15 gam
B. 30 gam
C. 18 gam
D. 24 gam
Lời giải:
Ta có, nFe = 0,45 mol và nSO2 = 0,375 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
1,35 = 2x + 0, 75→ x = 0,3
Mặt khác ta có: nên: m = 25,2 + 0,3. 16 = 30 (gam).
9. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
Fe3O4 + CO → 3FeO + CO2↑