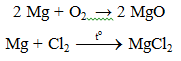Chúng tôi xin giới thiệu phương trình 2Mg + SO2 → 2MgO + S gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Magie. Mời các bạn đón xem:
Phương trình 2Mg + SO2 → 2MgO + S
1. Phương trình phản ứng hóa học:
2Mg + SO2 → 2MgO + S
2. Hiện tượng nhận biết phản ứng
Tạo thành kết tủa màu xám đen MgO
3. Điều kiện phản ứng
Nhiệt độ
4. Tính chất hóa học
- Magie là chất khử mạnh:
Mg → Mg2+ + 2e
a. Tác dụng với phi kim
Lưu ý:
- Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
5. Cách thực hiện phản ứng
Cho kim loại Mg tác dụng với khí SO2
6. Bạn có biết
Mg tham gia phản ứng các chất khí có tính oxi hóa như SO2
7. Bài tập liên quan
Ví dụ 1: Thực hiện các thí nghiệm sau:
(1) Nung hỗn hợp Fe và KNO3 trong khí trơ
(2) Cho luồng khí H2 đi qua bột CuO nung nóng.
(3) Đốt dây Mg trong bình kín chứa đầy SO2.
(4) Nhúng dây Ag vào dung dịch HNO3
Số thí nghiệm xảy ra phản ứng oxi hóa kim loại:
A. 1
B. 4
C. 2
D. 3
Hướng dẫn giải:
Đáp án D
Các phản ứng xảy ra:
(1) 2KNO3 → 2KNO2 + O2
3Fe + 2O2 → Fe3O4
(2) CuO + H2 → Cu + H2O.
(3) 2Mg + SO2 → S + 2MgO
(4) 3Ag + 4HNO3 → 3AgNO3 + 2H2O + NO
Ví dụ 2: Cho 7,8 g Mg tác dụng với khí SO2 nung nóng thu được 14,2 g chất rắn. Thể tích khí SO2 (đktc) tham gia phản ứng là
A. 1,12 lít
B. 2,24 lít
C. 5,6 lít
D. 3,36 lít
Hướng dẫn giải:
Đáp án B
Định luật bảo toàn khối lượng: mSO2 = mcr - mMg = 14,2 – 7,8 = 6,4 g
⇒ nSO2 = 0,1 mol ⇒ VSO2 = 2,24 lít
Ví dụ 3: Cho các nhận định sau:
(1). Khi sục SO2 vào dung dịch H2S thì dung dịch chuyển thành màu nâu đen.
(2). SO2 luôn thể hiện tính khử trong các phản ứng với O2, nước Br2, dung dịch KMnO4.
(3). SO2 phản ứng với Mg nung nóng thu được chất rắn màu đen.
(4). Hiện tượng xảy ra khi dẫn khí H2S vào dung dịch hỗn hợp KMnO4 và H2SO4 là dung dịch bị mất màu tím.
(5). Các chất O3, KClO4, H2SO4, Fe(NO3)3 chỉ có tính oxi hóa.
(6). Bạc tiếp xúc với không khí có lẫn H2S bị hóa đen.
(7). Tác nhân chủ yếu gây mưa axit là SO2, NO2.
(8). Sục khí H2S vào dung dịch FeCl2 không xảy ra phản ứng.
Số nhận định đúng là:
A. 4
B. 3
C. 5
D. 6
Hướng dẫn giải:
Đáp án C
(1). Sai. Khi sục SO2 vào dung dịch H2S thì xảy ra phản ứng:
SO2 + 2H2S→3S↓ +2H2O nên dung dịch bị vẩn đục màu vàng.
(2). Đúng. Vì xảy ra các phản ứng:
O2 + 2SO2 ↔ 2SO2
SO2 + Br2 + 2H2O→2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O→K2SO4+ 2MnSO4 + 2H2SO4
(3). Đúng. SO2 + 2Mg → 2MgO + S
(4). Sai. Dung dịch mất màu tím và có kết tủa vàng xuất hiện.
(5). Sai. Vì Fe(NO3)3 có thể hiện tính khử:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
(6). Đúng. Do phản ứng: 4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O.
(7). Đúng.
(8). Đúng. Vì FeS có khả năng tan trong axit loãng.
8. Một số phương trình phản ứng hoá học khác của Magie và hợp chất: