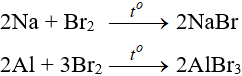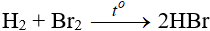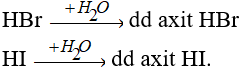Chúng tôi xin giới thiệu phương trình C6H6 + Br2 → C6H5Br + HBr gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C6H6 + Br2 → C6H5Br + HBr
1. Phương trình phản ứng hóa học
C6H6 + Br2 → C6H5Br + HBr
2. Hiện tượng nhận biết phản ứng
- Màu của brom nhạt dần và thấy có khí hidro bromua (HBr) thoát ra
3. Điều kiện phản ứng
- Nhiệt độ, xúc tác: bột sắt
4. Bản chất của các chất tham gia phản ứng
Benzen chỉ tham gia phản ứng thế với brom lỏng và cần có xúc tác là bột sắt (Chú ý: Benzen chỉ phản ứng với Brom nguyên chất không phản ứng với dung dịch nước Brom hay benzen không làm mất màu dung dịch brom ở điều kiện thường)
5. Tính chất hóa học
5.1. Tính chất hóa học của C6H6
Tính chất hóa học nổi bật của benzen là phản ứng thế, phản ứng cộng và phản ứng oxi hóa. Và đây cũng là 3 tính chất hóa học phổ biến của các chất thuộc đồng đẳng benzen hoặc các hiđrocacbon thơm.
Phản ứng thế
C6H6+ Br2 → C6H5Br + HBr (Fe, to)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, to)
Phản ứng cộng
C6H6 + 3H2 → xiclohexan (Ni, to)
C6H6 + 3Cl2 → C6H6Cl6 (as) (hexacloran hay 666 hay 1,2,3,4,5,6 - hexacloxiclohexan)
Phản ứng oxi hóa
Benzen không làm mất màu dung dịch KMnO4.
Oxi hóa hoàn toàn:
C6H6 + 7,5O2 → 6CO2+ 3H2O (to)
5.2. Tính chất hóa học của Br2
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
b. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
6. Cách thực hiện phản ứng
- Đun nóng hỗn hợp benzen và brom, có mặt bột sấy
7. Bạn có biết
- Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
8. Bài tập liên quan
Câu 1. Phản ứng benzen tác dụng với clo tạo C6H6Cl6 xảy ra trong điều kiện:
A. Có bột Fe xúc tác
B. Có ánh sáng khuyếch tán
C. Có dung môi nước
D. Có dung môi CCl4
Lời giải:
Đáp án: B
Câu 2. Nhận định nào sau đây là sai?
A. Benzen có khả năng tham gia phản ứng thế tương đối dễ hơn phản ứng cộng.
B. Benzen tham gia phản ứng thế dễ hơn ankan.
C. Các đồng đẳng của benzen làm mất màu dung dịch thuốc tím khi đun nóng.
D. Các nguyên tử trong phân tử benzen cùng nằm trên một mặt phẳng.
Lời giải:
Đáp án: B
Giải thích:
Nhận định sai “Benzen tham gia phản ứng thế dễ hơn ankan”.
Câu 3. Khẳng định nào sau đây không đúng khi nói về stiren ?
A. Stiren tham gia phản ứng trùng hợp.
B. Stiren là đồng đẳng của benzen.
C. Stiren làm mất màu dung dịch Br2 .
D. Stiren là chất lỏng, không màu, không tan trong nước.
Lời giải:
Đáp án: B
Câu 4. Cho các nhận định sau:
(1) Dẫn khí etilen qua dung dịch brom có màu da cam, sau phản ứng dung dịch brom bị mất màu.
(2) Pentan không làm mất màu dung dịch KMnO4.
(3) Tất cả ankin đều tác dụng với dung dịch AgNO3/NH3 tạo kết tủa vàng.
(4) Propilen cộng nước thu được sản phẩm chính ancol bậc II.
(5) Benzen làm mất màu dung dịch Br2 ở mọi điều kiện.
Số nhận định đúng là
A. 3.
B. 4.
C. 5.
D. 2.
Lời giải:
Đáp án: A
Giải thích:
(1) đúng
Phương trình hóa học: CH2 = CH2 + Br2 → Br - CH2 - CH2 - Br
(2) đúng, vì pentan là ankan không làm mất màu dung dịch KMnO4.
(3) sai, chỉ có ank-1-in tác dụng được với dung dịch AgNO3/NH3 tạo kết tủa vàng.
(4) đúng, vì propilen cộng nước thu được sản phẩm chính là ancol bậc II (theo quy tắc cộng Maccopnhicop).
Phương trình hóa học: CH2=CH-CH3 + H2OCH3-CH(OH)-CH3.
(5) sai, vì benzen không phản ứng với dung dịch Br2 ở mọi điều kiện, (chỉ phản ứng với brom khan khi có xúc tác Fe, to).
⟹ Có tất cả 3 nhận định đúng.
Câu 5. Cho các phát biểu sau:
(1) Nhỏ vài giọt dung dịch nước Br2 vào phenol thấy dung dịch brom nhạt màu và có kết tủa trắng xuất hiện.
(2) Hidro hóa axetilen (xúc tác Pd/PbCO3, to)bằng một lượng vừa đủ hidro thu được eten.
(3) Để phân biệt but-2-en và but-2-in ta có thể sử dụng dung dịch AgNO3/NH3
(4) Trong công nghiệp có thể điều chế axit axetic bằng cách oxi hóa rượu etylic.
Số phát biểu đúng là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án: C
Giải thích:
(1) Nhỏ vài giọt dung dịch nước Br2 vào phenol thấy dung dịch brom nhạt màu và có kết tủa trắng xuất hiện.
(2) Hidro hóa axetilen (xúc tác Pd/PbCO3,to)bằng một lượng vừa đủ hidro thu được eten.
(4) Trong công nghiệp có thể điều chế axit axetic bằng cách oxi hóa rượu etylic.
Câu 6. Có các lọ đựng hóa chất riêng rẽ: Na2S, NaCl, AgNO3, Na2CO3. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó ?
A. dung dịch NaOH.
B. dung dịch H2SO4.
C. dung dịch HCl.
D. phenolphtalein.
Lời giải:
Đáp án: C
Câu 7: Thể tích không khí cần dùng để đốt cháy hoàn toàn 0,1 mol benzen và 0,2 mol striren là (đo ở đktc):
A. 84 lít
B. 61,6 lít
C. 224 lít
D. 308 lít
Lời giải:
Đáp án: D
Giải thích:
C6H6 + 15/2 O2 → 6CO2 + 3H2O
Mol 0,1 → 0,75
→Vkk = VO2/20% = (0,75.22,4)/20% = 84 (lit)
Câu 8. Hóa chất để phân biệt: benzen, axetilen, striren là:
A. Dung dịch Brom
B. Dung dịch Brom, Dung dịch AgNO3/NH3
C. Dung dịch AgNO3
D. Cu(OH)2, dung dịch AgNO3/NH3
Lời giải:
Đáp án: B
Giải thích:
Khi cho KMnO4 ở điều kiện thường vào lần lượt các ống nghiệm
Ống đựng axetilen và stiren làm nhạt màu KMnO4.
Ống đựng benzen không hiện tượng.
Cho tiếp 2 dung dịch axetilen và stiren vào dung dịch AgNO3/ NH3, đun nóng
Ống đựng axetilen có lớp Ag màu trắng xám
Ống đựng stiren không hiện tượng.
Câu 9. Benzen tác dụng với Cl2 có ánh sáng, thu được hexaclorua. Công thức của hexaclorua là
A. C6H6Cl2
B. C6H6Cl6
C. C6H5Cl
D. C6H6Cl4
Lời giải:
Đáp án: B
Câu 10. TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
A. 550,0 gam.
B. 687,5 gam.
C. 454,0 gam.
D. 567,5 gam.
Lời giải:
Đáp án: C
Giải thích:
C6H5CH3 + 3HNO3 C6H2(NO2)3CH3 + 3H2O (1)
gam: 92 → 227
gam: 230.80% → x
Theo phương trình và giả thiết ta thấy khối lượng TNT (2,4,6-trinitrotoluen) tạo thành từ 230 gam toluen với hiệu suất 80% là :
x = (230 . 80% . 227)/ 92 = 454 gam.
9. Một số phương trình phản ứng hoá học khác của Carbon (C) và hợp chất:
C6H6 + Br2 → C6H5Br + HBr