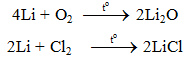Chúng tôi xin giới thiệu phương trình 2Li + Cl2 → 2LiCl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình hóa học của Li. Mời các bạn đón xem:
Phương trình 2Li + Cl2 → 2LiCl
1. Phương trình phản ứng hóa học:
2Li + Cl2 → 2LiCl
2. Hiện tượng nhận biết phản ứng
Liti phản ứng mãnh liệt với khí clo tạo muối màu trắng LiCl
3. Điều kiện phản ứng
- Nhiệt độ thường
4. Tính chất hóa học
- Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
a. Tác dụng với phi kim
b. Tác dụng với axit
- Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
c. Tác dụng với nước
- Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
d. Tác dụng với hidro
- Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
5. Cách thực hiện phản ứng
- Cho liti tác dụng với khí clo thu được muối liticlorua.
6. Bạn có biết
Liti có tính khử rất mạnh, tham gia phản ứng với halogen (Cl2; Br2,…) phản ứng tỏa nhiều nhiệt tạo thành muối.
7. Bài tập liên quan
Ví dụ 1: Cách bảo quản Li đúng nhất :
A. Để ngoài không khí
B. Ngâm trong rượu
C. Ngâm trong dầu hỏa
D. Ngâm trong nước tinh khiết
Đáp án: C
Ví dụ 2: Cho 0,7 g Li tác dụng với khí clo thu được m g muối. Giá trị của m là
A. 4,25 g
B. 2,125 g
C. 3,1875 g
D. 6,375 g
Đáp án: A
Hướng dẫn giải:
Phương trình hóa học: 2Li + Cl2 → 2LiCl
NLiCl = nLi = 0,1 mol ⇒ mLiCl = 0,1.42,5 = 4,25 g
Ví dụ 3: Cho Li tác dụng với Clo ở nhiệt độ thường. Hiện tượng phản ứng xảy ra là:
A. Li nóng chảy cháy sáng trong khí clo
B. Li phản ứng dịu nhẹ với khí clo
C. Li phản ứng tỏa nhiều nhiệt khi tác dụng với khí clo ở nhiệt độ thường.
D. Li tác dụng mãnh liệt với khí clo khi tiếp xúc.
Đáp án: A
8. Một số phương trình phản ứng hóa học khác của Li: