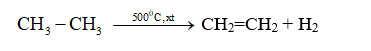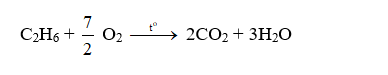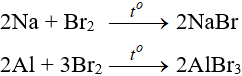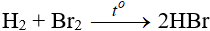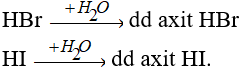Chúng tôi xin giới thiệu phương trình C2H6 + 2Br2 → C2H5Br + 2HBr gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C2H6 + 2Br2 → C2H5Br + 2HBr
1. Phản ứng hóa học:
C2H6 + 2Br2 
2. Điều kiện phản ứng
- Đun nóng.
3. Cách thực hiện phản ứng
- Khi có đun nóng, khí etan (C2H6) phản ứng với brom (tỉ lệ 1:2) thu được C2H4Br2 và hiđro bromua (HBr – khí).
4. Hiện tượng nhận biết phản ứng
- Trước khi đun nóng hỗn hợp phản ứng có màu nâu đỏ (của brom ). Sau khi phản ứng xảy ra hỗn hợp sản phẩm thu được không có màu.
(Xét phản ứng xảy ra hoàn toàn và vừa đủ, không có chất dư).
5. Tính chất hóa học
5.1. Tính chất hóa học của C2H6
a. Phản ứng thế bởi halogen
- Khi chiếu sáng hoặc đốt nóng hỗn hợp etan và clo sẽ xảy ra phản ứng thế lần lượt các nguyên tử hidro bằng clo. Tương tự như metan.
C2H6 + Br2 → C2H5Br + HBr
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất halogen.
b. Phản ứng tách (gãy liên kết C-C và C-H)
c. Phản ứng oxi hóa
- Khi đốt, etan bị cháy tạo ra CO2, H2O và tỏa nhiều nhiệt.
- Nếu không đủ oxi, ankan bị cháy không hoàn toàn, khi đó ngoài CO2 và H2O còn tạo ra các sản phẩm như CO, than muội, không những làm giảm năng suất tỏa nhiệt mà còn gây độc hại cho môi trường.
5.2. Tính chất hóa học của Brom
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
b. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
6. Bạn có biết
- Phản ứng trên được gọi là phản ứng thế.
- Ankan không màu mất màu dung dịch brom ở điều kiện thường.
7. Bài toán liên quan
Ví dụ 1: Brom hóa etan theo tỉ lệ mol 1:2. Phản ứng nào sau đây đúng ?
A. Br2 + C2H6 → C2H5Br + HBr
B. 2Br2 + C2H6 → C2H4Br2 + 2HBr
C. 3Br2 + C2H6 → C2H3Br3 + 3HBr
D. 4Br2 + C2H6 → C2H2Br4 + 4HBr
Hướng dẫn:
Brom hóa theo tỉ lệ 1:2 ⇒ Phương trình phản ứng là:
2Br2 + C2H6 → C2H4Br2 + 2HBr
Đáp án B.
Ví dụ 2: Brom hóa 3 gam ankan X thì thu được 18,8 gam dẫn xuất đibrom. Tìm CTPT của ankan X:
A. CH4
B. C2H6
C. C3H8
D. C4H10
Hướng dẫn:
Đáp án B.
Ví dụ 3: Cho các chất sau : metan, etan, propen, anđehit fomic. Số chất không làm mất màu dung dịch brom:
A. 1
B. 2
C. 3
D. 4
Hướng dẫn:
Chất không làm mất màu dung dịch brom là: metan, etan vì nó là hidrocacbon no.
Đáp án B.
8. Một số phương trình phản ứng hoá học khác của Ankan và hợp chất: