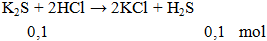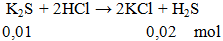Chúng tôi xin giới thiệu phương trình K2S + 2HCl → 2KCl + H2S gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình K2S + 2HCl → 2KCl + H2S
1. Phương trình phản ứng hóa học:
K2S + 2HCl → 2KCl + H2S
2. Hiện tượng nhận biết phản ứng
- Có khí không màu, mùi trứng thôi thoát ra.
3. Điều kiện phản ứng
- điều kiện thường,
4. Tính chất hóa học
- Chất này có thể điều chế bằng cách đun nóng K2SO4 với carbon (than cốc):
- K2SO4 + 4C → K2S + 4CO↑
Trong phòng thí nghiệm K2S nguyên chất có thể điều chế bằng cách cho kali hóa hợp với lưu huỳnh trong môi trường amonia khan.
- Muối sulfide là muối rất cơ bản, do vậy K2S hoàn toàn thủy phân trong nước theo phản ứng sau đây:
- K2S + H2O → KOH + KHS
Đối với nhiều mục đích, phản ứng này không quan trọng vì hỗn hợp của HS− và OH− phản ứng như dung dịch S2−. Các muối sulfide của kim loại kiềm khác (trừ Na) cũng có tính chất tương tự.
5. Cách thực hiện phản ứng
- Nhỏ HCl vào ống nghiệm chứa K2S
6. Bạn có biết
- K2S phản ứng với các axit như H2SO4, HBr… đều giải phóng khí.
7. Bài tập liên quan
Ví dụ 1: Nhỏ HCl vào ống nghiệm chứa K2S thu được hiện tượng là
A. Có khí không màu, mùi trứng thối thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Hướng dẫn giải
K2SO3 + 2HCl → 2KCl + SO2 + H2O
H2S: khí không màu, mùi trứng thối.
Đáp án A.
Ví dụ 2: Thể tích khí ở dktc thoát ra khi cho 11g K2S phản ứng hoàn toàn với lượng dư HCl là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3: Cho 1,1g K2S phản ứng hoàn toàn với lượng HCl, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,548 gam.
B, 0,745 gam.
C. 0,475 gam.
D. 1,49 gam.
Hướng dẫn giải
khối lượng muối = 0,02.74,5 = 1,49 gam.
Đáp án D.
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất: