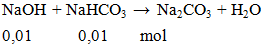Chúng tôi xin giới thiệu phương trình NaOH + NaHCO3 → Na2CO3 + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình NaOH + NaHCO3 → Na2CO3 + H2O
1. Phương trình phản ứng hóa học:
NaOH + NaHCO3 → Na2CO3 + H2O
2. Hiện tượng nhận biết phản ứng
Nhỏ BaCl2 vào sản phẩm tạo thành thấy thu được kết tủa.
3. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
4. Viết phương trình ion rút gọn NaHCO3+ NaOH
Phương trình ion:
Na+ + HCO3−+ Na+ + OH− → 2Na+ + CO32− + H2O
Phương trình ion thu gọn:
HCO3− + OH− → CO32− + H2O
5. Bản chất của các chất tham gia phản ứng
a. Bản chất của NaHCO3 (Natri hidrocacbonat)
NaHCO3 là một muối axit nhưng thể hiện tính axit yếu. NaHCO3 khi tác dụng với NaOH sẽ tạo thành muối trung hoà và nước.
b. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng với axit tạo thành muối và nước.
6. Tính chất hóa học
6.1. Tính chất hóa học của NaOH (Natri hidroxit)
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
6.2. Tính chất hóa học của NaHCO3 (Natri hidrocacbonat)
Natri hidrocacbonat là một muối axit nhưng thể hiện tính axit yếu. Bên cạnh đó, Natri hidrocacbonat có thể tác dụng với axit mạnh hơn, giải phóng khí CO2, nên Natri hidrocacbonat cũng thể hiện tính bazơ và tính này chiếm ưu thế hơn tính axit.
- Ít tan trong nước, trong dung dịch phân li hoàn toàn thành ion.
NaHCO3 → Na+ + HCO3-
- Natri Bicarbonat bị phân huỷ ở 270 độ, tham gia phản ứng nhiệt phân tạo muối và giải phóng khí CO2.
2NaHCO3 (nhiệt độ)→ Na2CO3 +CO2↑ + H2O
- Natri bicarbonat thuỷ phân trong môi trường kiềm yếu. Trường hợp này có thể dùng quỳ tím và metyl để nhận biết.
NaHCO3 + H2O ⇄ H2CO3 + NaOH
- Natri bicarbonat là một hợp chất lưỡng tính, vừa có tính axit vừa có tính bazơ.
- Tác dụng với các dung dịch kiềm (NaOH, KOH…). Đây là một ví dụ điển hình cho phản ứng trung hòa.
NaHCO3 + NaOH → Na2CO3 + H2O
2NaHCO3 + Ca(OH )2 → Na2CO3 + CaCO3 + H2O
NaHCO3 + Ca(OH)2 → NaOH + CaCO3 + H2O
- Phản ứng của 2 muối axit với nhau: (muối axit mạnh sẽ đóng vai trò là axit; muối axit yếu sẽ đóng vai trò là bazơ)
NaHSO4 + NaHCO3 → Na2SO4 + CO2 + H2O
- Tác dụng với axit: (muối của axit yếu phản ứng với axit mạnh tạo ra muối mới + axit yếu hơn)
HCl + NaHCO3 → NaCl + CO2 + H2O
- Tác dụng với muối:
NaHCO3 + AlCl3 + H2O → NaCl + CO2 + Al(OH)3
NaHCO3 + FeCl3 + H2O → Fe(OH)3 + NaCl + CO2
- Tác dụng với oxit axit:
NaHCO3 + SO2 → NaHSO3 + CO2
7. Cách thực hiện phản ứng
- Nhỏ từ từ dung dịch NaOH vào ống nghiệm chứa NaHCO3
8. Bạn có biết
NaOH có thể phản ứng với các muối hiđrocacbonat để thu được muối cacbonat.
9. Bài tập liên quan
Ví dụ 1: NaOH không thể phản ứng với dung dịch muối nào sau?
A. KHCO3.
B. NaHSO3.
C. CuCl2.
D. KCl.
Hướng dẫn giải
NaOH không thể phản ứng với dung dịch KCl.
Đáp án D.
Ví dụ 2: NaOH phản ứng với chất nào sau không thu được kết tủa?
A. CuCl2.
B. FeCl2.
C. NaHCO3.
D. MgCl2.
Hướng dẫn giải
NaOH + NaHCO3 → Na2CO3 (dd) + H2O
Đáp án C.
Ví dụ 3: Số mol NaOH cần dung để phản ứng hoàn toàn với 0.84g NaHCO3 là
A. 0,001.
B. 0,01.
C. 0,1.
D. 1.
Hướng dẫn giải
Đáp án B.