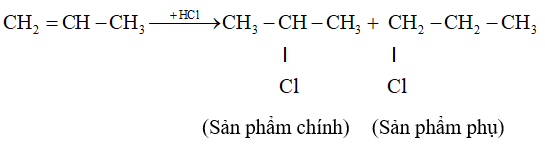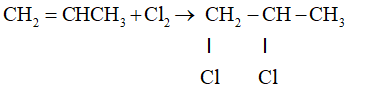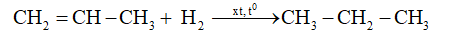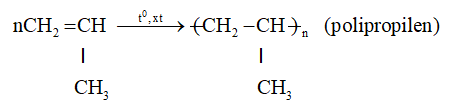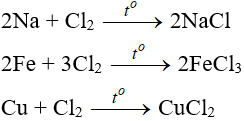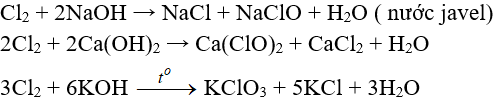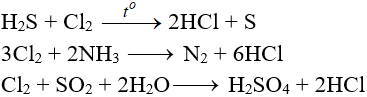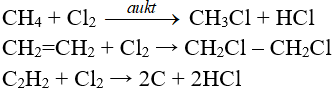Chúng tôi xin giới thiệu phương trình CH2=CH–CH3+ Cl2 → CH2Cl–CHCl– CH3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình CH2=CH–CH3+ Cl2 → CH2Cl–CHCl– CH3
1. Phản ứng hóa học:
CH2=CH–CH3 + Cl2 → CH2Cl–CHCl– CH3
2. Điều kiện phản ứng
- Chất xúc tác FeCl3
3. Cách thực hiện phản ứng
- Cho khí propilen tác dụng với khí clo có xúc tác FeCl3
4. Hiện tượng nhận biết phản ứng
- Mất màu vàng lục của khí clo.
5. Tính chất hóa học
5.1. Tính chất hóa học của C3H6
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
Phản ứng cộng axit hoặc nước vào propen thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
- Cộng Brom
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
b. Phản ứng trùng hợp
- Propen trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Propen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C3H6 + O2 → 3CO2 + 3H2O
- Propen làm mất màu dung dịch KMnO4:
3C3H6 + 2KMnO4 + 4H2O → 2KOH + 2MnO2 + 3C3H6(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
5.2. Tính chất hóa học của Clo
a. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
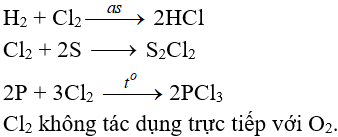
b. Tác dụng với phim kim
(cần có nhiệt độ hoặc có ánh sáng)
c. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
a. Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
b. Tác dụng với dung dịch bazơ
d. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
e. Tác dụng với chất khử khác
f. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
6. Bạn có biết
- Phản ứng trên gọi là phản ứng cộng.
- Tương tự propilen, các anken khác cũng tác dụng với Cl2
- Tỉ lệ phản ứng luôn là 1:1
7. Bài tập liên quan
Ví dụ 1: Cho khí propilen tác dụng với khí clo xúc tác FeCl3 thu được chất X.
X là:
A. clopropan
B. 1,2 điclopropan
C. Propylclorua
D. 2,3 - điclopropan
Hướng dẫn
Phương trình phản ứng:
CH2=CH– CH3 + Cl2 → CH2Cl–CHCl–CH3
CH2Cl–CHCl– CH3 có tên gọi là 1,2-điclopropan
Ví dụ 2: Cho 2,24 lít khí propilen tác dụng vừa đủ với V lít khí Cl2 (đktc). Giá trị của V là:
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,6 lít
Hướng dẫn
Phương trình phản ứng:
CH2=CH–CH3 + Cl2 → CH2Cl–CHCl–CH3
nCl2 = npropilen = 0,1 mol ⇒ V = 0,1.22,4 = 2,24 lít
Đáp án A
Ví dụ 3: Trong hợp chất propilen có bao nhiêu liên kết pi và liên kết xichma
A. 1 và 7
B. 1 và 9
C. 2 và 8
D. 2 và 5
Hướng dẫn
CH2=CH–CH3 : 1 liên kết đôi = 1 liên kết pi + 1 liên kết xichma
Đáp án B
8. Một số phương trình phản ứng hóa học khác của Anken và hợp chất
CH2=CH–CH3 + HCl → CH3–CHCl–CH3
CH2=CH–CH3 + HBr → CH3-CHBr–CH3
CH2=CH–CH3 + H2O → CH3-CHOH–CH3
CH2=CH–CH3 + H2SO4 → CH3–CHOSO3H–CH3
nCH2=CH–CH3 → (-CH2–CH(CH3) -)n
3CH2=CH–CH3 + 4H2O + 2KMnO4 → 3OH-CH2–CH(OH)– CH3 + 2MnO2 + 2KOH