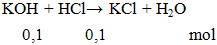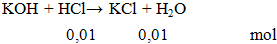Chúng tôi xin giới thiệu phương trình KOH + HCl → KCl + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình KOH + HCl → KCl + H2O
1. Phương trình phản ứng hóa học:
KOH + HCl → KCl + H2O
2. Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ tím có màu xanh, sau khi nhỏ từ từ HCl mẩu quỳ mất màu, dư HCl quỳ chuyển sang màu đỏ.
3. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
4. Tính chất hóa học
- KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
Ở điều kiện nhiệt độ phòng, KOH tác dụng với oxit axit như SO2, CO2
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
- KOH tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
- KOH tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
- KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới
KOH + Na → NaOH + K
- KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
- KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion Na+ và OH-
Phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
- KOH phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
5. Cách thực hiện phản ứng
- Nhỏ từ từ HCl vào dung dịch KOH có chứa một mẩu quỳ tím.
6. Bạn có biết
- Phản ứng giữa KOH và HCl là phản ứng trung hòa.
7. Bài tập liên quan
Ví dụ 1: Cho 0,1 mol KOH phản ứng vừa đủ với 100ml HCl aM. Giá trị của a là
A. 0,1.
B. 0,01.
C. 0,05.
D. 1.
Đáp án D.
Hướng dẫn giải
a = 0,1 : 0,1 = 1M.
Ví dụ 2: Phản ứng nào sau đây là phản ứng trung hòa?
A. 2KOH + CO2 → K2CO3 + H2O
B. KOH + SO2 → KHSO3
C. KOH + HCl → KCl + H2O
D. 2KOH + CuSO4 → K2SO4 + Cu(OH)2
Đáp án C.
Hướng dẫn giải
Phản ứng trung hòa là phản ứng KOH + HCl → KCl + H2O
Ví dụ 3: Cho 100ml HCl 0,1M phản ứng vừa đủ với dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 0,745g.
B. 7,45g.
C. 0,754g.
D. 7,54g.
Đáp án A.
Hướng dẫn giải
mmuối = 0,01.74,5 = 0.745 gam.
Ví dụ 4: Cho m gam KOH tác dụng vừa đủ với 3,65 gam HCl. Sau phản ứng thu được muối kali clorua và nước. Giá trị m bằng bao nhiêu?
A. 5,6
B. 2,8
C. 4,2
D. 6,3
Đáp án A
Hướng dẫn giải
nHCl = 3,65/36,5 = 0,1 mol
Phương trình phản ứng xảy ra
KOH + HCl → KCl + H2O
Theo phương trình phản ứng: nKOH = nHCl = 0,1 mol
=> Khối lượng của KOH là: 0,1. (39 + 16 + 1) = 5,6 gam
Ví dụ 5: Cho các kim loại: Cu, Zn, Fe, Mg, Ag, Al. Những kim loại nào không tác dụng với dd HNO3đặc nguội?
A. Fe, Mg, Ag, Al.
B. Cu, Mg, Ag, Al.
C. Fe, Al.
D. Tất cả các kim loại
Đáp án B
Ví dụ 6: Dãy chất nào dưới đây thuộc bazo tan
A. NaOH, KOH, Al(OH)3; Fe(OH)2
B. KOH, Al(OH)3, Fe(OH)2, Ba(OH)2
C. KOH, Ba(OH)2, Al(OH)3, Fe(OH)2
D. NaOH, KOH, Ca(OH)2, Ba(OH)2
Đáp án D
Hướng dẫn giải
Dãy chất thuộc bazo tan NaOH, KOH, Ca(OH)2, Ba(OH)2
Ví dụ 7: Dung dịch KOH có thể tác dụng được với những chất nào sau đây?
A. SO2; HCl; AgNO3; Cu
B. CuO; SO2; HCl; AgNO3
C. SO2; HCl; AgNO3; Na2CO3
D. NaHCO3; SO2; HCl; AgNO3
Đáp án D
Hướng dẫn giải
Dung dịch KOH có thể tác dụng được với những chất: NaHCO3; SO2; HCl; AgNO3
2 NaHCO3 + 2 KOH → Na2CO3 + K2CO3 + 2 H2O
SO2 + KOH → K2SO3 + H2O
KOH + HCl → KCl + H2O
2 AgNO3 + 2 KOH → Ag2O + H2O + 2 KNO3
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
2KOH + CuSO4 → K2SO4 + Cu(OH)2