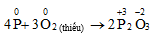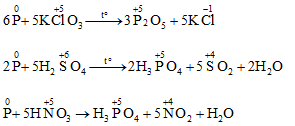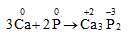Chúng tôi xin giới thiệu phương trình P + KClO3 → KCl + P2O5 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Đồng . Mời các bạn đón xem:
Phương trình P + KClO3 → KCl + P2O5
1. Phương trình phản ứng hóa học:
6P + 5KClO3 → 5KCl + 3P2O5
2. Hiện tượng nhận biết phản ứng.
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm KCl (kali clorua) (trạng thái: lỏng) (màu sắc: không màu), P2O5 (diphotpho penta oxit) (trạng thái: rắn) (màu sắc: trắng), được sinh ra
Hoặc bạn phải quan sát chất tham gia KClO3 (kali clorat) (trạng thái: rắn) (màu sắc: trắng), P (photpho) (trạng thái: rắn) (màu sắc: đỏ), biến mất.
3. Điều kiện phản ứng
- Nhiệt độ cao
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của P (Photpho)
- Trong phản ứng trên P là chất khử.
- P vừa có tính khử vừa có tính oxi hoá nên P khử được một số hợp chất có tính oxi hoá mạnh.
4.2. Bản chất của KClO3 (Kali clorat)
- Trong phản ứng trên KClO3 là chất oxi hoá.
- KClO3 là hợp chất có tính oxi hoá mạnh tác dụng được với nhiều phi kim tạo muối như S, P, Mg.
5. Tính chất hóa học
5.1. Tính chất hóa học của Photpho (P)
- Tính khử
a. Khử phi kim mạnh hơn:O2, Cl2, S...
- Khử O2 :
Photpho trắng tác dụng với oxi ở điều kiện thường, phản ứng tỏa năng lượng ở dạng ánh sáng → gây ra hiện tượng phát quang hóa học
Photpho đỏ chỉ tác dụng với oxi ở nhiệt độ cao
- Khử : 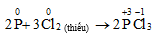
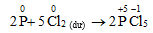
b. Khử một số hợp chất có tính oxi hóa mạnh
- Tính oxi hóa
* P oxi hóa các kim loại hoạt động tạo ra photphua kim loại
5.2. Tính chất hóa học của KClO3 (Kali clorat)
- KClO3 là chất hợp chất có tính oxi hóa mạnh. Nó có thể phản ứng với nhiều kim loại và phi kim để tạo ra phản ứng tạo muối
2KClO3 + 3S → 2KCl + 3SO2
KClO3 + 3Mg → KCl + 3MgO
5KClO3 + 6P → 5KCl + 3P2O5
2Al + KClO3 → Al2O3 + KCl
3C + 2KClO3→2KCl + 3CO2
2Fe + KClO3 → Fe2O3 + KCl
- Ngoài ra hợp chất này có thể gây ra hiện tượng sau: hỗn hợp của kali clorua với đường – lưu huỳnh và bột nhôm sẽ nổi khi tác dụng đập mạnh
- Các phương trình phản ứng khác:
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
2KClO3 + 3MnO2 → 2KMnO4 + MnCl2 + 2O2
KClO3 + 3H2 → KCl + 3H2O
- KClO3 nhiệt phân tạo ra muối clorua
- Ở nhiệt độ 400℃ hợp chất bị phân hủy thành muối kali peclorat và kali clorua
4KClO3 → 3KClO4 + KCl
- Ở nhiệt độ 500℃ hợp chất bị phân hủy thành muối kali clorua và oxy
2KClO3 → 2KCl + 3O2↑
6. Cách thực hiện phản ứng
- Cho KClO3 (kali clorat) tác dụng P (photpho) ở nhiệt độ cao và tạo ra chất KCl (kali clorua), P2O5 (diphotpho penta oxit)
7. Bạn có biết
8. Bài tập liên quan
Câu 1. Cho phản ứng: P + KClO3 → P2O5 + KCl. Hệ số cân bằng của phương trình phản ứng này từ trái qua phải lần lượt là:
A. 2, 1, 1, 1
B. 4, 3, 2, 3
C. 8, 1, 4, 1
D. 6, 5, 3, 5
Lời giải:
Đáp án: D
Câu 2. Photpho thể hiện tính oxi hóa ở phản ứng nào sau đây?
A. 2P + 5Cl2 2PCl5
B. 2P + 5O2 2P2O5
C. P + 5HNO3⟶ H3PO4 + 5NO2+ H2O
D. 3Ca + 2P Ca3P2
Lời giải:
Đáp án: D
Câu 3. Trong phản ứng của photpho với (1) Ca, (2) O2, (3) Cl2, (4) KClO3. Những phản ứng trong đó photpho thể hiện tính khử là
A. (1), (2), (4).
B. (1), (3).
C. (2), (3), (4).
D. (1), (2), (3).
Lời giải:
Đáp án: C
Câu 4. Đốt cháy photpho trong khí clo dư, phản ứng xảy ra hoàn toàn, sau phản ứng ta thu được hợp chất nào?
A. PCl3
B. PCl5
C. PCl2
D. PCl6
Lời giải:
Đáp án: B
Câu 5. Phát biểu nào sau đây là sai?
A. cấu hình electron nguyên tử của photpho là 1s22s22p63s23p6.
B. Photpho chỉ tồn tại ở 2 dạng thù hình photpho đỏ và photpho trắng.
C. Photpho trắng hoạt động mạnh hơn photpho đỏ
D. Ở nhiệt độ thường photpho hoạt động mạnh hơn nitơ.
Đáp án B
B sai vì photpho có thể tồn tại ở nhiều dạng thù hình khác nhau nhưng quan trọng nhất là photpho trắng và photpho đỏ.
Câu 6. Hai khoáng vật chính của photpho là:
A. Apatit và hematit
B. Pirit và photphorit
C. Apatit và photphorit
D. Manhetit và apatit
Đáp án C
Câu 7. Cho sơ đò chuyển hóa: P2O5 → X → Y → Z. Các chất X, Y, Z lần lượt là
A. KH2PO4, K2HPO4, K3PO4
B. KH2PO4, K3PO4, K2HPO4
C. K3PO4, KH2PO4, K2HPO4,
D. K3PO4, K2HPO4, KH2PO4
Đáp án C
Câu 8. Thủy phân hoàn toàn 5,42 gam PX3 trong nước thu được dung dịch A. Trung hòa dung dịch A cần dùng 100 ml dung dịch NaOH 1M. Biết rằng H3PO3 là một axit 2 nấc. Công thức của PX3 là
A. PBr3.
B. PI3.
C. PF3.
D. PCl3.
Đáp án A
PX3 (x) + 3H2O → H3PO3 (x) + 3HX (3x mol)
2NaOH + H3PO3 → Na2HPO3 + 2H2O
NaOH + HX → NaX + H2O
nNaOH = 2nH3PO3 + nHX = 5x = 0,1 ⇒ x = 0,02 mol
PX3 = 5,42 : 0,02 = 271 ⇒ X = 80 ⇒ Br ⇒ PBr3
Câu 9. Photpho hoạt động hoá học mạnh hơn nitơ trong điều kiện thường là do
A. độ âm điện của photpho (2,2) nhỏ hơn của nitơ (3,0).
B. trong điều kiện thường photpho ở trạng thái rắn, còn nitơ ở trạng thái khí.
C. liên kết trong phân tử photpho kém bền hơn trong phân tử nitơ.
D. photpho có nhiều dạng thù hình, còn nitơ chỉ có một dạng thù hình.
Đáp án C
Trong điều kiện thường, photpho hoạt động hoá học mạnh hơn nitơ là do liên kết trong phân tử photpho kém bền hơn trong phân tử nitơ.
Câu 10. Khi đun nóng trong điều kiện không có không khí, photpho đỏ chuyển thành hơi, sau đó làm lạnh phần hơi thì thu được photpho
A. đỏ.
B. vàng.
C. trắng.
D. nâu.
Đáp án C
Khi đun nóng trong điều kiện không có không khí, photpho đỏ chuyển thành hơi, sau đó làm lạnh phần hơi thì thu được photpho trắng.
9. Một số phương trình phản ứng hoá học khác của Photpho (P) và hợp chất: