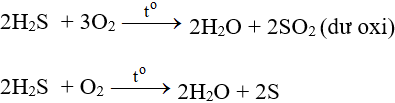Chúng tôi xin giới thiệu phương trình Mn + H2S → MnS + H2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Mangan. Mời các bạn đón xem:
Phương trình Mn + H2S → MnS + H2
1. Phương trình phản ứng hóa học:
Mn + H2S → MnS + H2
2. Hiện tượng nhận biết phản ứng
Xuất hiện kết tủa màu hồng
Có khí không màu thoát ra
3. Điều kiện phản ứng
Không cần điều kiện
4. Tính chất hoá học
a. Tính chất hoá học của Mangan
- Trạng thái ôxi hóa phổ biến của nó là +2, +3, +4, +6 và +7. Trạng thái ôxy hóa ổn định nhất là mangan +2.
- Mangan có tính khử khá mạnh
Tác dụng với phi kim
- Tác dụng trực tiếp được với nhiều phi kim.
Mn (bột) + O2→ MnO2. (tự bốc cháy)
Mn + Cl2 → MnCl2.
Tác dụng với axit
- Tác dụng với HCl và H2SO4 loãng:
Mn (bột) + 2HCl (loãng) → MnCl2 + H2
- Tác dụng với HNO3 và H2SO4 đặc:
Mn + 2H2SO4 (đặc) → MnSO4 + SO2 + 2H2O.
3Mn + 8HNO3 (loãng, nóng) → 3Mn(NO3)2 + 2NO + 4H2O.
Tác dụng với nước
Mn (bột) + 2H2O (hơi) → Mn(OH)2 + H2
b. Tính chất hoá học của H2S
Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
- Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
- Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
5. Cách thực hiện phản ứng
Cho mangan tác dụng với H2S
6. Bạn có biết
Mangan dễ tham gia phản ứng với các dung dịch axit không có tính oxi hóa tạo muối và khí hidro thoát ra.
7. Bài tập liên quan
Ví dụ 1: Cho Mn tác dụng với H2S thu được muối và 3,36 lít khí H2 (đktc). Khối lượng muối thu được sau phản ứng:
A.8,7g
B. 13,05g
C. 17,4g
D. 21,75 g
Hướng dẫn giải:
Đáp án B
Phương trình phản ứng: Mn + H2S → MnS + H2
n muối = nH2 = 0,15 mol ⇒ m muối = 0,15. 87 = 13,05 g
Ví dụ 2: Cho 5,5 g Mn tác dụng với H2S dư thu được V lít khí H2 ở đktc. Giá trị của V là:
A. 1,12 lít
B. 2,24 lít
C. 5,6 lít
D. 3,36 lít
Hướng dẫn giải:
Đáp án B
Phương trình phản ứng: Mn + H2S → MnS + H2
nH2 = nMn = 0,1 mol ⇒VH2 = 0,1.22,4 = 2,24 lít
Ví dụ 3: Cho phản ứng sau : Mn + H2S → MnS + H2
Mn đóng vai trò là :
A. chất khử
B. chất oxi hóa
C. môi trường
D. cả A,B và C
Hướng dẫn giải:
Đáp án A
8. Một số phương trình phản ứng hoá học khác của Mangan (Mn) và hợp chất:
4Mn + 10HNO3 → 4Mn(NO3)2 + NH4NO3 + 3H2O
3Mn + 2H3PO4 → Mn3(PO4)2 + 3H2
2KMnO4 + 3H2S → 2KOH + 2MnO2↓ + 3S↓ + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O