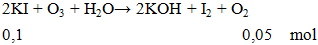Chúng tôi xin giới thiệu phương trình 2KI + O3 + H2O → 2KOH + I2 + O2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình 2KI + O3 + H2O → 2KOH + I2 + O2
1. Phương trình phản ứng hóa học:
2KI + O3 + H2O → 2KOH + I2 + O2
2. Hiện tượng nhận biết phản ứng
- sản phẩm sinh ra làm xanh hồ tinh bột.
3. Điều kiện phản ứng
- điều kiện thường.
4. Tính chất hóa học
- Kali iotua bị oxi hóa thành iod tự do bởi các chất oxi hóa mạnh như axit sunfuric đặc, kali pemanganat, khí clo:
4KI + 2CO2 + O2 → 2K2CO3 + 2I2
Phản ứng này dùng để phân tách iod từ khoáng chất thiên nhiên.
- Cũng giống như các muối iodua khác, KI tạo muối triiođua I3- khi xử lý với I2:
KI(l) + I2 (r) → KI3 (l)
- Potassium iodide cũng được sử dụng trong việc tráng phim:
KI(l) + AgNO3 (l) → AgI(r) + KNO3 (l)
- Phản ứng oxy hóa khử khi cho KI tác dụng với K2SO3.
2KI + SO3 → I2 + K2SO3
2KI + 2FeCl3 → 2FeCl2 + I2 + 2KCl
- Phương trình hóa học hữu cơ
KI + CH3CH(Br)CH2(Br) → KBr + IBr + CH2=CHCH3
5. Cách thực hiện phản ứng
- dẫn khí O3 vào ống nghiệm chứa KI và vài giọt hồ tinh bột.
6. Bạn có biết
- Phản ứng này chứng minh ozon có tính oxi hóa mạnh hơn oxi.
7. Bài tập liên quan
Ví dụ 1: Phản ứng nào chứng minh ozon có tính oxi hóa mạnh hơn oxi?
A. Lần lượt đốt cháy C trong oxi và ozon.
B. Cho oxi, ozon phản ứng với nước.
C. cho ozon vào dung dịch KI có sẵn vài giọt hồ tinh bột.
D. Cho ozon, oxi phản ứng với Au.
Hướng dẫn giải
2KI + O3 + H2O → 2KOH + I2 + O2
Đáp án C.
Ví dụ 2: Cho ozon vào bình đựng KI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là
A. Dung dịch hiện màu vàng nâu.
B. Dung dịch hiện màu xanh.
C. Dung dịch có màu trắng.
D. Có kết tủa màu vàng nhạt.
Hướng dẫn giải
2KI + O3 + H2O → 2KOH + I2 + O2
I2 sinh ra làm xanh hồ tinh bột.
Đáp án B.
Ví dụ 3: Thể tích khí O2 ở đktc sinh ra khi cho ozon phản ứng vừa đủ với 0,1 mol KI là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,05.22,4 = 1,12 lít.
Đáp án A.
Ví dụ 4: Tiến hành các thí nghiệm sau
(1) O3 tác dụng với dung dịch KI.
(2) axit HF tác dụng với SiO2.
(3) khí SO2 tác dụng với nước Cl2.
(4) KClO3 đun nóng, xúc tác MnO2.
(5) Cho H2S tác dụng với SO2.
Số thí nghiệm tạo ra đơn chất là:
A. 3
B. 2
C. 4
D. 1
Đáp án A
Hướng dẫn giải
Các thí nghiệm tạo ra đơn chất là (1) (4) (5)
(1) O3 + KI + H2O → KOH + I2 + O2
(4) KClO3→ KCl + O2
(5) H2S + SO2→ S + H2O
Ví dụ 5: Để phân biệt khí O2 và O3 có thể dùng hóa chất
A. khí H2.
B. dung dịch KI và hồ tinh bột.
C. kim loại đồng.
D. hồ tinh bột
Đáp án B
Ví dụ 6: Người ta điều chế oxi trong phòng thí nghiệm bằng cách phân hủy H2O2 (xt MnO2), khí oxi sinh ra thường bị lẫn hơi nước. Người ta có thể làm khô khí oxi bằng cách dẫn khí qua ống sứ chứa chất nào sau đây?
A. Na.
B. bột CaO.
C. CuSO4.5H2O.
D. S.
Đáp án B
Ví dụ 7: Cho khí X đi qua dung dịch KI có pha thêm hồ tinh bột, dung dịch chuyển màu xanh. X là khí nào sau đây?
A. N2.
B. O2.
C. O3.
D. CO2.
Đáp án C
Hướng dẫn giải
Phương trình hóa học:
2KI + O3 + H2O → I2 + 2KOH + O2 (dung dịch thu được làm xanh hồ tinh bột)
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
2KI + 2FeCl3 → I2 + 2FeCl2 + 2KCl
2KI + 2Fe(NO3)3 → I2 + 2Fe(NO3)2 + 2KNO3
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
8HNO3 + 6KI → 6KNO3 + 3I2 + 2NO + 4H2O