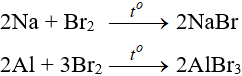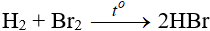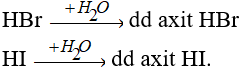Chúng tôi xin giới thiệu phương trình HCOOH + Br2 → HBr + CO2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình HCOOH + Br2 → HBr + CO2
1. Phương trình phản ứng hóa học
HCOOH + Br2 → 2HBr + CO2
2. Hiện tượng nhận biết phản ứng.
- Khi cho Axit fomic tác dụng Br2, sau phản ứng ta thấy mất màu dung dịch Brom có khí thoát ra
3. Điều kiện phản ứng
- Nhiệt độ thường
4. Tính chất hóa học
4.1. Tính chất hóa học của HCOOH
a. Tính Axit
Dung dịch HCOOH làm quỳ tím chuyển màu đỏ nhạt.
Axit Fomic tác dụng với kim loại mạnh và giải phóng khí Hidro
-
- 2Na + 2HCOOH –> 2HCOONa + H2
Axit Fomic tác dụng với oxit bazơ tạo thành nước và sản phẩm tương ứng
-
- CuO + 2HCOOH –> (HCOO)2Cu + H2O
Axit Fomic tác dụng với muối của axit yếu hơn:
-
- NaHCO3 + HCOOH –> HCOONa + CO2 + H2O
- C6H5ONa + HCOOH –> HCOONa + C6H5OH.
b. Tính chất của nhóm -COOH:
Đặc trưng nổi bật của nhóm này chính là phản ứng Este hóa. Đây là phản ứng thuận nghịch được xúc tác nhờ axit sunfuric đặc và nhiệt độ.
PTPƯ HCOOH + CH3OH –> HCOOCH3 + H2O.
c. Phản ứng tráng gương
Phản ứng tráng gương còn được gọi là phản ứng tráng bạc. Đây là loại phản ứng đặc trưng của anđehit. Đặc trưng của phản ứng tráng gương là tính khử. Khi nhóm chức anđehit khi tác dụng với AgNO3 hoặc Ag2O trong môi trường NH3 tạo ra Ag.
-
- HCOOH + 2[Ag(NH3)2]OH –> (NH4)2CO3 + 2Ag(kết tủa) + 2NH3(khí) + H2O
4.2. Tính chất hóa học của Br2
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
b. Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
5. Cách thực hiện phản ứng
- Cho HCOOH tác dụng với Br2
6. Bạn có biết
- Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Br2 (brom) ra CO2 (Cacbon dioxit)
7. Bài tập liên quan
Câu 1. Số chất làm mất màu nước brôm trong các chất sau: (1) cumen, (2) benzyl amin, (3) anđehit axetic, (4) ancol anlylic, (5) phenol, (6) Vinyl axetat, (7) axit fomic
A. 7
B. 4
C. 6
D. 5
Câu 2. Để nhận biết các chất riêng biệt sau: C2H5OH, HCOOH, C6H5OH, C2H4(OH)2 ta dùng cặp hoá chất nào sau đây?
A. Dung dịch Br2 và Cu(OH)2
B. Dung dịch Br2và dung dịch NaOH
C. NaHCO3 và Cu(OH)2
D. Na và quỳ tím
Câu 3. Este có khả năng tác dụng với dung dịch nước Br2 là
A. CH2=CHCOOH
B. HCHO
C. (CH3[CH2]7CH=CH[CH2]7COO)3C3H5
D. CH3COOCH3
8. Một số phương trình phản ứng hoá học khác của Brom (Br) và hợp chất:
HCOOH + Br2 → HBr + CO2