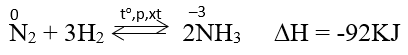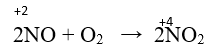Chúng tôi xin giới thiệu phương trình 3Mn + N2 → Mn3N2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Mangan. Mời các bạn đón xem:
Phương trình 3Mn + N2 → Mn3N2
1. Phương trình phản ứng hóa học:
3Mn + N2 → Mn3N2
2. Hiện tượng nhận biết phản ứng
Xuất hiện chất rắn màu xám đen
3. Điều kiện phản ứng
Nhiệt độ từ 690°C - 1200°C
4. Tính chất hoá học
a. Tính chất hoá học của Mangan
- Trạng thái ôxi hóa phổ biến của nó là +2, +3, +4, +6 và +7. Trạng thái ôxy hóa ổn định nhất là mangan +2.
- Mangan có tính khử khá mạnh
Tác dụng với phi kim
- Tác dụng trực tiếp được với nhiều phi kim.
Mn (bột) + O2→ MnO2. (tự bốc cháy)
Mn + Cl2 → MnCl2.
Tác dụng với axit
- Tác dụng với HCl và H2SO4 loãng:
Mn (bột) + 2HCl (loãng) → MnCl2 + H2
- Tác dụng với HNO3 và H2SO4 đặc:
Mn + 2H2SO4 (đặc) → MnSO4 + SO2 + 2H2O.
3Mn + 8HNO3 (loãng, nóng) → 3Mn(NO3)2 + 2NO + 4H2O.
Tác dụng với nước
Mn (bột) + 2H2O (hơi) → Mn(OH)2 + H2
b. Tính chất hoá học của N2
- Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
- N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
- Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
- Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
Tính oxi hoá: Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
Tác dụng với hidro
Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
Tác dụng với kim loại
- Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
- Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý: Các nitrua dễ bị thủy phân tạo NH3.
Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
Tính khử
- Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
- Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
- Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Ghi nhớ: Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn. Thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện lớn hơn.
5. Cách thực hiện phản ứng
Cho mangan phản ứng với nitơ
6. Bạn có biết
Mangan cháy trong nitơ ở nhiệt độ cao từ 690°C - 1200°C để tạo thành chất rắn màu xám đen
7. Bài tập liên quan
Ví dụ 1: Mangan tác dụng được với những chất nào sau đây ?
A. N2, H2SO4 loãng , KNO3
B. H2SO4 đặc nguội ,O2, NaOH
C. S, H2SO4 đặc nguội, N2
D. HNO3, NaOH, S
Hướng dẫn giải:
Đáp án C
Mn + S → MnS
3Mn + N2 → Mn3N2
Mn + 2H2SO2(đ,nguội) → MnSO4 + 2H2O + SO2
Ví dụ 2: . Cho 16,5 g Mn tác dụng vừa hết với m g nitơ phản ứng xảy ra hoàn toàn. Giá trị của m là:
A. 0,56g
B. 5,6 g
C. 0,28 g
D. 2,8 g
Hướng dẫn giải:
Đáp án D
Phương trình hóa học : 3Mn + N2 → Mn3N2
Ta có : nN2 = 1/3 . nMn = 0,1 mol ⇒ mN2 = 0,1.28 = 2,8 g
Ví dụ 3: Cho 8,25 g Mn tác dụng vừa hết với 1,4 g nitơ phản ứng xảy ra hoàn toàn thì thu được m g chất rắn màu xám đen .Giá trị của m là:
A. 9,65g
B. 19,3 g
C. 0,965 g
D. 1,93 g
Hướng dẫn giải:
Đáp án A
Phương trình hóa học : 3Mn + N2 → Mn3N2
Theo ĐLBTKL ta có : mMn + mN2 = mMn3N2 ⇒ mMn3N2 = 8,25 + 1,4 = 9,65 g
8. Một số phương trình phản ứng hoá học khác của Mangan (Mn) và hợp chất:
Mn + H2SO4(loãng) → MnSO4 + H2
Mn(bột) + 2H2O → Mn(OH)2 + H2 ↑