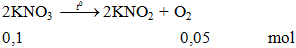Chúng tôi xin giới thiệu phương trình 2KNO3 -to→ 2KNO2 + O2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình 2KNO3 -to→ 2KNO2 + O2
1. Phương trình phản ứng hóa học:
2KNO3 -to→ 2KNO2 + O2
2. Hiện tượng nhận biết phản ứng
- Có khí thoát ra, khối lượng chất rắn sau phản ứng giảm so với trước phản ứng.
3. Điều kiện phản ứng
- Phản ứng xảy ra khi nung nóng.
4. Tính chất hóa học
Nó có thể tham gia nhiều phản ứng hóa học như oxi hóa khử, tác dụng với axit, oxit, phản ứng phân hủy….
- Phản ứng oxi hóa khử của KNO3
S + 2KNO3 + 3C -> K2S + N2 + 3CO2
Nó còn được gọi là phản ứng bột đen, lưu huỳnh và kali nitrat là chất oxy hóa.
- Phản ứng oxi hóa trong môi trường axit
6FeSO4 + 2KNO3 (đậm đặc) + 4H2SO4 -> K2SO4 + 3Fe2(SO4)3 + 2NO + 4H2O
- Phản ứng phân hủy để tạo oxi
2KNO3 -> 2KNO2 + O2↑
5. Cách thực hiện phản ứng
- Nhiệt phân KNO3.
6. Bạn có biết
- Tương tự như KNO3, các muối nitrat của kim loại hoạt động mạnh bị phân hủy tạo ra muối nitrit và oxi.
7. Bài tập liên quan
Ví dụ 1: Nhiệt phân muối KNO3 thu được sản phẩm là
A. KNO2, O2.
B. K2O, O2.
C. K2O, NO2, O2.
D. K, NO2, O2.
Hướng dẫn giải
2KNO3 
Đáp án A.
Ví dụ 2: Nhiệt phân muối nitrat nào sau không thu được muối nitrit?
A. KNO3.
B. NaNO3.
C. LiNO3.
D. Mg(NO3)2.
Hướng dẫn giải
2Mg(NO3)2 
Đáp án D.
Ví dụ 3: Thể tích khí ở đktc thoát ra khi nhiệt phân hoàn toàn 10,1g KNO3 là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0.05.22,4= 1,12 lít.
Đáp án A.
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
2KNO3 + 3Cu + 8HCl → 2KCl + 3CuCl2 + 2NO + 4H2O
2KNO3 + 3Cu + 4H2SO4 → K2SO4 + 3CuSO4 + 2NO + 4H2O
2KNO3 + 3Mg + 4H2SO4 → K2SO4 + 3MgSO4 + 2NO + 4H2O
2KNO3 + 3Zn + 4H2SO4 → K2SO4 + 3ZnSO4 + 2NO + 4H2O
2KNO3 + 2Fe + 4H2SO4 → K2SO4 + Fe2(SO4)3 + 2NO + 4H2O