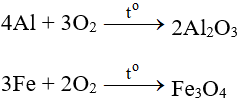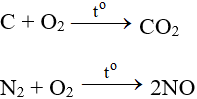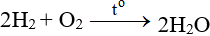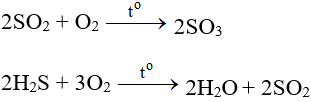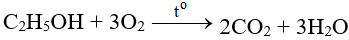Chúng tôi xin giới thiệu phương trình NH3 + O2 → NO + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Đồng . Mời các bạn đón xem:
Phương trình NH3 + O2 → NO + H2O
1. Phương trình phản ứng hóa học:
4NH3 + 5O2 → 4NO + 6H2O
2. Hiện tượng nhận biết phản ứng.
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), NO (nitơ oxit) (trạng thái: khí) (màu sắc: không màu), được sinh ra
Hoặc bạn phải quan sát chất tham gia NH3 (amoniac) (trạng thái: khí) (màu sắc: không màu), O2 (oxi) (trạng thái: khí) (màu sắc: không màu), biến mất.
3. Điều kiện phản ứng
- Nhiệt độ: 850 - 900oC
- Xúc tác: Bạch kim (Pt) (hoặc Fe2O3, Cr2O3)
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của NH3 (Amoniac)
- Trong phản ứng trên NH3 là chất khử.
- N trong NH3 có mức oxi hoá thấp nhất là -3 nên NH3 có tính khử mạnh và tác dụng được với O2.
b. Bản chất của O2 (Oxi)
Trong phản ứng trên O2 là chất oxi hoá.
5. Tính chất hóa học
5.1. Tính chất hóa học của Amoniac (NH3)
- Amoniac có tính bazơ yếu
Amoniac do tính bazơ nên dung dịch amoniac làm cho quỳ tím hóa xanh còn dung dịch phenolphlatein từ màu chuyển thành hồng.
Do đó để phát hiện amoniac, người ta dùng quỳ tím ẩm để nhận biết.
Nguyên nhân: do cặp e chưa tham gia liên kết ở nguyên tử N
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
a) Amoniac phản ứng với nước
NH3 + H2O ⇔ NH4+ + OH-
b) Amoniac phản ứng với Axit → Muối Amoni
Thí dụ:
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
c) Amoniac tác dụng với dung dịch muối của các kim loại mà hidroxit không tan → bazơ và muối
NH3 + Muối (dung dịch) → Bazơ + Muối mới
Thí dụ
2NH3+ MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
3NH3 + AlCl3+ 3H2O →Al(OH)3↓ + 3NH4Cl
* Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan
Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
Thí dụ:
ZnSO4+ 2NH3+ 2H2O → Zn(OH)2↓ + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)3](OH)2
- Amoniac có tính khử mạnh
Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
a) Amoniac tác dụng với O2
4NH3 + 3O2 2N2↑ + 6H2O
4NH3 + 5O2 4NO↑ + 6H2O
b) Amoniac tác dụng với Cl2
2NH3 + 3Cl2 N2↑ + 6HCl
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
c) Amoniac tác dụng với oxit của kim loại
Thí dụ:
3CuO + 2NH3 Cu + 3H2O + N2↑
- Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
5.2. Tính chất hóa học của Oxi (O2)
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Cách thực hiện phản ứng
- Cho NH3 (amoniac) tác dụng O2 (oxi) và tạo ra chất H2O (nước), NO (nitơ oxit)
7. Bạn có biết
8. Bài tập liên quan
Câu 1. Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
C. có kết tủa keo trắng, không thấy kết tủa tan.
D. dung dịch trong suốt.
Lời giải:
Dẫn NH3 vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
=> Hiện tượng Có kết tủa keo trắng không tan
Câu 2. Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Lời giải:
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3NaOH + AlCl3 → Al(OH)3 ↓ + 3NaCl
Sau đó kết tủa keo trắng tan trong NaOH dư tạo dung dịch trong suốt (vì Al(OH)3 có tính lưỡng tính tan được trong dung dịch axit dư, và kiềm dư)
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 3. Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước ?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Lời giải:
Câu 4. Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là:
A. HCl, O2, Cl2, FeCl3.
B. H2SO4, Ca(OH)2, FeO, KOH
C. HCl, HNO3, AlCl3, CaO
D. KOH, HNO3, CuO, CuCl2
Lời giải:
NH3 + HCl → NH4Cl
4NH3+ 5O2 → 4NO + 6H2O
8NH3 + 3Cl2 → N2 + 6NH4Cl
FeCl3+ 3NH3 + 3H2O → Fe(OH)3 + 3NH4Cl
Câu 5. Dung dịch NH3 có thể tác dụng được với các dung dịch
A. HCl, CaCl2
B. KNO3, H2SO4
C. ZnCl2, AlCl3
D. Ba(NO3)2, HNO3
Lời giải:
Phương trình phản ứng minh họa
ZnCl2 + 6NH3 → (Zn(NH3)6)Cl2
2NH3 + AlCl3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
Câu 6. Cho NH3 dư vào 50ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
A. 9,8 gam
B. 3,9 gam
C. 7,8 gam
D. 5 gam
Lời giải:
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức
=> kết tủa thu được chỉ gồm Al(OH)3
nAl(OH)3 = nAlCl3 = 0,05 mol => m = 3,9 gam
Câu 7. Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
A. 3,0M.
B. 1,0M.
C. 2,0M.
D. 2,5M.
Lời giải:
NH4++ OH−→ NH3+ H2O
Theo phương trình hóa học ta có
nOH - = nNH3 = 5,622,4 = 0,25 mol
=> CM = nV = 0,250,1 = 2,5M
Câu 8. Nhận xét nào dưới đây không đúng về muối amoni
A. Các muối amoni đều là chất điện li mạnh
B. Muối amoni kém bền với nhiệt
C. Dung dịch của các muối amoni luôn có môi trường bazơ
D. Tất cả muối amoni tan trong nước
Đáp án B
Tất cả các muối amoni đều tan và là những chất điện li mạnh.
(NH4)xM → xNH4+ + Mx-
Nếu muối amoni của axit mạnh (A là gốc axit của một axit mạnh) thì thủy phân tạo môi trường axit.
NH4+ + H2O ↔ NH3 + H3O+
Muối amoni còn dễ bị phân hủy bởi nhiệt → NH3 và axit tương ứng.
Dung dịch của các muối amoni luôn có môi trường bazơ
Câu 9. Sục khí NH3 từ từ đến dư vào dung dịch CuCl2 thì hiện tượng quan sát được là
A. có kết tủa màu xanh lam xuất hiện, lượng kết tủa tăng dần, tới một lúc nào đó thì kết tủa lại bị hòa tan dần đến hết, dung dịch trở nên trong suốt có màu xanh thẫm.
B. có kết tủa màu đỏ xuất hiện, lượng kết tủa tăng dần, tới một lúc nào đó thì kết tủa lại bị hòa tan dần đến hết, dung dịch trở nên trong suốt có màu xanh lam.
C. có kết tủa màu xanh lam xuất hiện, kết tủa không tan.
D. không có hiện tượng gì xảy ra.
Đáp án A
2NH3 + 2H2O + CuCl2 → 2NH4Cl + Cu(OH)2
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Câu 10. Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
A. Fe(OH)3, Al(OH)3.
B. Fe(OH)3, Al(OH)3, Mg(OH)2.
C. Fe(OH)2, Al(OH)3, Cu(OH)2.
D. Fe(OH)3, Cu(OH)2, Mg(OH)2.
Đáp án B
NH3 dư có Cu(OH)2 và Zn(OH)2 tạo phức tan
=> kết tủa thu được gồm Fe(OH)3, Al(OH)3, Mg(OH)2.
9. Một số phương trình phản ứng hoá học khác:
NH3 + O2 → NO + H2O