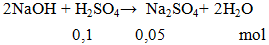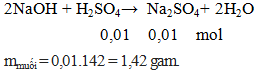Chúng tôi xin giới thiệu phương trình 2NaOH + H2SO4 → Na2SO4 + 2H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình 2NaOH + H2SO4 → Na2SO4 + 2H2O
1. Phương trình phản ứng hóa học:
2NaOH + H2SO4 → Na2SO4+ 2H2O
2. Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ tím có màu xanh, sau khi nhỏ từ từ H2SO4 mẩu quỳ mất maù, dư H2SO4 quỳ chuyển sang màu đỏ.
3. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
4. Tính chất hóa học
4.1. Tính chất hóa học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
4.2. Tính chất hóa học của H2SO4
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
5. Cách thực hiện phản ứng
- Nhỏ từ từ H2SO4 vào dung dịch NaOH có chứa một mẩu quỳ tím.
6. Bạn có biết
- Phản ứng giữa NaOH và H2SO4 là phản ứng trung hòa.
7. Bài tập liên quan
Ví dụ 1: Cho 0,1 mol NaOH phản ứng vừa đủ với 100ml H2SO4 aM. Giá trị của a là
A. 0,1.
B. 0,01.
C. 0,05.
D. 0,5.
Hướng dẫn giải
a = 0,05 : 0,1 = 0,5M.
Đáp án D.
Ví dụ 2: Phản ứng nào sau đây không là phản ứng trung hòa?
A. NaOH + HNO3 → NaNO3 + H2O
B. 2NaOH + H2SO4 → Na2SO4+ 2H2O
C. NaOH + HCl → NaCl + H2O
D. 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Hướng dẫn giải
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓ không là phản ứng trung hòa
Đáp án D.
Ví dụ 3: Cho 100ml H2SO4 0,1M phản ứng vừa đủ với dung dịch NaOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 1,74g.
B. 1,01g.
C. 1,42g.
D. 1,10g.
Hướng dẫn giải
Đáp án C.
8. Một số phương trình phản ứng hóa học khác của Natri và hợp chất:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓
2NaOH + Mg(NO3)2 → 2NaNO3 + Mg(OH)2↓
NaOH + Al(OH)3 → NaAlO2 + 2H2O