Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 32: Hợp chất của sắt chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Hợp chất của sắt lớp 12.
Bài giảng Hóa học 12 Bài 32: Hợp chất của sắt
Giải bài tập Hóa học 12 Bài 32: Hợp chất của sắt
Câu hỏi và bài tập (trang 145 SGK Hóa Học 12)
Bài 1 trang 145 SGK Hóa Học 12: Viết phương trình hóa học của các phản ứng trong quá trình chuyển đổi sau:
Lời giải:
Bài 2 trang 145 SGK Hóa Học 12: Cho sắt tác dụng với dung dịch H2SO4 loãng thu được V lít khí H2 (đktc), dung dịch thu được cho bay hơi thu được tinh thể FeSO4.7H2O có khối lượng là 55,6 gam. Thể tích khí H2(đktc) được giải phóng là :
A.8,19 lít. B.7,33 lít.
C.4,48 lít. D.6,23 lít.
Phương pháp giải:
PTHH: Fe + H2SO4 → FeSO4 + H2
Bảo toàn nguyên tố Fe: nFeSO4 = nFeSO4.7H2O
Từ PTHH => nH2 = nFeSO4 => VH2
Lời giải:
ta có : Fe + H2SO4 → FeSO4 + H2
(mol)
Theo phương trình hóa học trên ta có (mol)
Vậy thể tích khí (lít)
Đáp án C
Bài 3 trang 145 SGK Hóa Học 12: Ngâm một đinh sắt nặng 4 gam trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857 gam. Khối lượng sắt tham gia phản ứng là :
A. 1,9990 gam B. 1,9999 gam.
C. 0,3999 gam D. 2,1000 gam.
Phương pháp giải:
Gọi số mol Fe phản ứng là x (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu
x x (mol)
Kim loại Cu sinh ra sẽ bám vào thanh sắt =>Dùng phương pháp tăng giảm khối lượng
Ta có:
∆mtăng = mCu – mFe pư
= 64x – 56x
=> x =?
Lời giải:
Fe + CuSO4 → FeSO4 + Cu
x x (mol)
Dùng phương pháp tăng giảm khối lượng
=> ∆mtăng = mCu – mFe pư
<=> (4,2875 - 4) = 64x – 56x
=> 8x = 0,2856
=> x = 0,0357125 (mol)
=> mFe pư = 0,0357125.56 = 1,999 (g)
Đáp án B
Bài 4 trang 145 SGK Hóa Học 12: Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là.
A.231 gam.
B.232 gam.
C.233 gam.
D. 234 gam.
Phương pháp giải:
Ghi nhớ:
Ta có thể gộp FeO và Fe2O3 thành Fe3O4 nếu chúng có tỉ lệ mol 1: 1
=> Coi hỗn hợp ban đầu chỉ có Fe3O4
Lời giải:
Cách 1:
Cách 2:
Có thể coi 0,5 mol FeO và 0,5 mol Fe2O3 là 0,5 mol Fe3O4.
Vậy cả hỗn hợp có 1 mol Fe3O4 nên có khối lượng là 232g.
Đáp án B
Bài 5 trang 145 SGK Hóa Học 12: Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là :
A.15 gam. B.20 gam.
C.25 gam. D.30 gam.
Lời giải:
(mol).
Fe2O3 + 3CO 2Fe + 3CO2
0,1 0,3 (mol)
CO2 + Ca(OH)2 → CaCO3 + H2O
0,3 0,3 (mol)
Vậy = 100. 0,3 = 30 (gam).
Đáp án D
Lý thuyết Bài 32: Hợp chất của sắtI. SẮT (II)
Có tính khử: Fe2+ Fe3+ + 1e và tính oxi hóa : Fe2+ + 2e Fe
1. Oxit FeO
- Chất rắn màu đen, không có trong tự nhiên, không tan trong nước
- Tác dụng được với axit sinh ra muối sắt (II) còn khi tác dụng với axit có tính oxi hóa mạnh thì thu được muối sắt (III)
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
- Điều chế bằng cách dùng CO hay H2 khử sắt (III) oxit ở 500oC
Fe2O3 + CO 2FeO + CO2
2. Hidroxit Fe(OH)2
- Là chất rắn, màu trắng hơi xanh, không tan trong nước.
- Dễ bị oxi hóa thành sắt (III) hiđroxit màu nâu đỏ trong không khí
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
- Có tính bazơ (tác dụng với axit (HCl, H2SO4 loãng) tạo nên muối sắt (II))
- Điều chế: trong môi trường không có oxi để thu được sản phẩm tinh khiết
3. Muối sắt (II)
- Đa số tan trong nước, khi kết tinh ở dạng ngậm nước.
- Dễ bị oxi hóa thành muối sắt (III)
2FeCl2 + Cl2 → 2FeCl3
- Chú ý: dung dịch muối sắt (II) điều chế được cần dùng ngay, vì trong không khí muối sắt (II) sẽ chuyển dần thành muối sắt (III).
- Điều chế: cho Fe (hoặc FeO, Fe(OH)2) tác dụng với HCl hoặc H2SO4 loãng:
Fe + 2HCl → FeCl2 + H2
FeO + H2SO4 → FeSO4 + H2
- Ứng dụng: muối FeSO4 được dùng làm chất diệt sâu bọ, pha chế sơn, mực nhuộm vải.
II. SẮT (III)
Có tính oxi hóa : tác dụng với một số kim loại, một số hợp chất có tính khử.
Fe3+ + 1e -> Fe2+ hoặc Fe3+ +3e -> Fe
1. Oxit Fe2O3
- Là chất rắn màu đỏ nâu, không tan trong nước
- Dễ tan trong cả dung dịch axit mạnh

- Ở nhiệt độ cao, Fe2O3 bị CO khử hoặc H2 khử thành Fe.
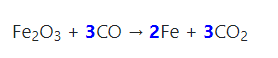
- Điều chế: qua phản ứng phân hủy sắt (III) hiđroxit ở nhiệt độ cao.
![]()
- Sắt (III) oxit tồn tại trong tự nhiên dưới dạng quặng hemantit dùng để luyện gang
2. Hidroxit Fe(OH)3
- Là chất rắn màu nâu đỏ, không tan trong nước nhưng dễ tan trong các dung dịch axit tạo muối sắt (III)
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
- Điều chế: cho dung dịch kiềm tác dụng với muối sắt (III).
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
3. Muối sắt (III)
- Các muối sắt (III) có tính oxi hóa, dễ bị khử thành muối sắt (II).
Fe + 2FeCl3 → 3FeCl2
- Bột đồng tan trong dung dịch muối sắt (III).
Cu + 2FeCl3 (vàng nâu) → CuCl2 + FeCl2
⇒ Dung dịch CuCl2 (màu xanh) và dung dịch FeCl2 (không màu) nên dung dịch thu được có màu xanh.

