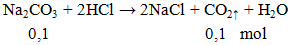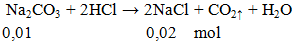Chúng tôi xin giới thiệu phương trình Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
1. Phương trình phản ứng hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- điều kiện thường,
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của Na2CO3 (Natri cacbonat)
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, khi Na2CO3 tác dụng với axit mạnh sẽ tạo thành muối và nước giải phóng khí CO2.
b. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với chất có tính bazo.
5. Tính chất hóa học
5.1. Tính chất hóa học của Na2CO3 (Natri cacbonat)
a. Tác dụng với axít tạo thành muối, nước và giải phóng khí CO2
Khi Axit dư thì
b. Tác dụng với bazơ tạo thành muối mới và bazơ mới
Na2CO3 + NaOH → NaCO3 + Na2OH
c. Tác dụng với muối tạo thành 2 muối mới
Na2CO3 + CaCl2 → 2NaCl + CaCO3
d. Tác dụng chuyển đổi qua lại với natri bicacbonat theo phản ứng
Na2CO3 + CO2 + H2O = 2NaCl + CaCO3
Ngoài ra hóa chất này không bị nhiệt phân hủy ở nhiệt độ cao và làm quỳ tím chuyển sang màu xanh
5.2. Tính chất hóa học của HCl (Axit clohidric)
- Axit HCl làm đổi màu quỳ tím: Khi nhúng quỳ tím vào dung dịch axit sẽ có hiện tượng quỳ tím chuyển đỏ.
- Axit clohidric tác dụng với kim loại đứng trước H, tạo thành muối và hidro
Fe + 2HCl → FeCl2 + H2↑
- Axit clohidric tác dụng với oxit kim loại, tạo thành muối Clorua và nước
6HCl + Al2O3 →2AlCl3 + 3H2O
- Axit clohidric tác dụng với Bazơ, tạo thành muối Clorua và nước
3HCl + Al(OH)3 → AlCl3 + 3H2O
- Axit clohidric tác dụng với muối, tạo thành muối mới và axit mới
AgNO3 + 2HCl → AgCl↓ + HNO3
- Axit clohidric tác dụng với hợp chất có tính oxi hoá, thể hiện tính khử
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
Lưu ý: Axit HCl sẽ không tác dụng với những kim loại đứng sau H trong dãy điện hoá, không tác dụng với các phi kim, axit, oxit kim loại, oxit phi kim.
6. Cách thực hiện phản ứng
- Nhỏ HCl vào ống nghiệm chứa Na2CO3.
7. Bạn có biết
- Na2CO3 phản ứng với các axit như H2SO4, HBr… đều giải phóng khí.
8. Bài tập liên quan
Ví dụ 1: Nhỏ HCl vào ống nghiệm chứa Na2CO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Hướng dẫn giải
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO2: khí không màu
Đáp án A.
Ví dụ 2: Thể tích khí ở dktc thoát ra khi cho 10,6g Na2CO3 phản ứng hoàn toàn với lượng dư HCl là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3: Cho 1,06g Na2CO3 phản ứng hoàn toàn với lượng HCl, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,17 gam.
B. 0,745 gam.
C. 0,475 gam.
D. 1,49 gam.
Hướng dẫn giải
khối lượng muối = 0,02.58,5 = 1,17 gam.
Đáp án A.
Ví dụ 4: Nhận định nào sau đây về muối nitrat là đúng?
A. Tất cả các muối nitrat đều tan trong nước.
B. Tất cả các muối nitrat đều bị nhiệt phân tạo ra oxit kim loại và nito dioxit.
C. Tất cả các muối nitrat đều bị nhiệt phân trừ muối nitrat của kim loại kiềm.
D. Tất cả các muối nitrat đều không tan trong nước.
Đáp án A
Hướng dẫn giải
Nhận định về muối nitrat là đúng là: Tất cả các muối nitrat đều tan trong nước.
Ví dụ 5: Phản ứng sản xuất vôi: CaCO3(r) → CaO(r) + CO2(k); ΔH > 0 .
Biện pháp kĩ thuật tác động vào quá trình sản xuất vôi để tăng hiệu suất phản ứng là
A. giảm nhiệt độ.
B. tăng nhiệt độ và giảm áp suất khí CO2.
C. tăng áp suất.
D. giảm nhiệt độ và tăng áp suất khí CO2.
Đáp án B
Hướng dẫn giải
Chiều thuận ( ∆H > 0):phản ứng thu nhiệt → tăng nhiệt độ cân bằng chuyển dịch theo chiều thuận
Giảm áp suất khí CO2 → Cân bằng chuyển dịch theo hướng tăng áp suất của hệ tức theo chiều thuận
Ví dụ 6: Nhóm các kim loại nào sau đây đều tác dụng được với nước tạo dung dịch kiềm:
A. Na, K, Mg, Ca.
B. Fe, Mg, Ca, Ba.
C. Ba, Na, K, Ca.
D. K, Na, Ca, Cu.
Đáp án C
Hướng dẫn giải
Phương trình phản ứng minh họa
Ba + 2H2O → Ba(OH)2 + H2
Na + H2O → NaOH + 1/2H2
K + H2O → KOH + 1/2H2
Ca + 2H2O → Ca(OH)2 + H2
Ví dụ 7: Muối NaHCO3 không thể tham gia phản ứng nào sau đây
A. Tác dụng với axit
B. Tác dụng với kiềm
C. Tác dụng nhiệt, bị nhiệt phân
D. Tác dụng với dung dịch Ba(NO3)2.
Đáp án D
Hướng dẫn giải
A. Tác dụng với axit
NaHCO3 + HCl → NaCl + CO2+ H2O
B. Tác dụng với kiềm
NaHCO3 + NaOH → Na2CO3 + H2O
C. Tác dụng nhiệt, bị nhiệt phân
2NaHCO3 → Na2CO3 + CO2 + H2O
D. NaHCO3 không Tác dụng với dung dịch Ba(NO3)2.
Ví dụ 8: Hỗn hợp R gồm 2 kim loại X và Y thuộc phân nhóm chính nhóm II, ở 2 chu kỳ liên tiếp. Cho 3,52 gam R tan hoàn toàn trong dung dịch HCl dư thu được 2,688 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là
A. 12,04 gam
B. 3,98 gam
C. 5,68 gam
D. 7,2 gam
Đáp án A
Hướng dẫn giải
Phương trình phản ứng: R + 2HCl → RCl2 + H2
Ta có nHCl = 2nH2 = 0,24 mol
mmuối = mkim loại+ mCl- = 3,52 + 0,24. 35,5 = 12,04 gam.
Ví dụ 9: Hấp thụ hoàn toàn 0,784 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,08 M thu được dung dịch X. Thêm 250 ml dung dich Y gồm BaCl2 0,08 M và Ba(OH)2 a mol/l vào dung dịch X thu được 1,97 gam kết tủa và dung dịch Z. Tính a?
A. 0,02 M
B. 0,04 M
C. 0,03M
D. 0,015 M
Đáp án B
Hướng dẫn giải
nCO2 = 0,035 mol; nNaOH = 0,04 mol
⇒ nNa2CO3 = 0,005 mol; nNaHCO3 = 0,03 mol
⇒ nBaCO3 = 0,01 mol < nBaCl2 = 0,02 mol ⇒ nCO32- = nBaCO3 = 0,01 mol
OH- + HCO3- → CO32-
nOH- = nCO32- = 0,01 mol ⇒ a = 0,005/0,125 = 0,04 mol
Ví dụ 10: Khi cắt miếng Na kim loại, bề mặt vừa cắt có ánh kim lập tức mờ đi, đó là do có sự hình thành các sản phẩm rắn nào sau đây?
A. Na2O, NaOH, Na2CO3, NaHCO3.
B. NaOH, Na2CO3, NaHCO3.
C. Na2O, Na2CO3, NaHCO3.
D. Na2O, NaOH, Na2CO3.
Đáp án A
Hướng dẫn giải
Do hàm lượng H2O và CO2 trong không khí khá nhiều:
H2O sễ chuyển Na → NaOH từ đó tác dụng với CO2
Na + H2O → NaOH + 1/2H2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2O + CO2 → 2NaHCO3
Ví dụ 11: Để điều chế kim loại Na, người ta thực hiện phản ứng:
A. Điện phân dung dịch NaOH.
B. Điện phân nóng chảy NaCl hoặc NaOH .
C. Cho dung dịch NaOH tác dụng với dung dịch HCl.
D. Cho dung dịch NaOH tác dụng với H2O.
Đáp án B
Hướng dẫn giải
Điện phân nóng chảy NaCl hoặc NaOH .
Khi điện phân NaOH nóng chảy thì ở catot (-) xảy ra quá trình khử Na+ thành Na, ở anot (+) xảy ra quá trình oxi hóa OH- thành O2 và H2O
4NaOH → 4Na + O2+ 2H2O
Ví dụ 12: Cho các dung dịch sau: KOH; KHCO3; K2CO3; KHSO4; K2SO4, CH3COOK. Dung dịch làm cho quỳ tím đổi màu xanh là:
A. KOH; K2SO4; Na2CO3, CH3COOK
B. KHSO4; KHCO3; K2CO3.
C. KOH; KHCO3; K2CO3.
D. KHSO4; KOH; KHCO3, CH3COOK
Đáp án C
Hướng dẫn giải
Dung dịch làm cho quỳ tím đổi màu xanh là: KHSO4; KOH; KHCO3, CH3COOK
Loại A vì K2SO4; Na2CO3 là muối trung tính
Loại B. KHSO4; KHCO3; K2CO3.
Loại D. KHSO4; KOH; KHCO3, CH3COOK
Ví dụ 13: Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,02.
B. 0,03.
C. 0,04.
D. 0,01.
Đáp án D
Hướng dẫn giải
Nhỏ từ từ HCl vào dung dịch thứ tự phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
nH+ = 0,03 mol
nCO32- = 0,02 mol < nH+
nH+ (2) = nCO2= 0,03 - 0,02 = 0,01 mol
Ví dụ 14: Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho HCl vào
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
C. không có khí thoát ra
D. có khí thoát ra và xuất hiện kết tủa
Đáp án B
Hướng dẫn giải
Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
Na2CO3 + 2HCl → 2NaCl + CO2+ H2O
9. Một số phương trình phản ứng hóa học khác của Natri và hợp chất:
Na2CO3 + 2HBr → 2NaBr + CO2 ↑ + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Na2CO3 + 2HNO3 → 2NaNO3 + CO2↑ + H2O
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3(↓)
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3(↓)