Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúng chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Kim loại kiềm thổ và hợp chất quan trọng của chúng lớp 12.
Bài giảng Hóa học 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúng
Giải bài tập Hóa học 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúng
Câu hỏi và bài tập (trang 119 SGK Hóa Học 12)
Bài 1 trang 119 SGK Hóa Học 12: Xếp các kim loại kiềm thổ theo chiều tăng dần của điện tích hạt nhân, thì
A. Bán kính nguyên tử giảm dần.B. Năng lượng ion hóa giảm dần.
C. tính khử giảm dần.
D. Khả năng tác dụng với nước giảm dần.
Lời giải:
Các kim loại kiềm thổ xếp theo chiều tăng dần điện tích hạt nhân thì:
Bán kính nguyên tử tăng dần, năng lượng ion hóa giảm dần, tính khử tăng dần, khả năng tác dụng với nước tăng dần.
Vậy A, C, D sai. B đúng
Đáp án B
Bài 2 trang 119 SGK Hóa Học 12: Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tủa trắng và bọt khí.
D. Không có hiện tượng gì.
Lời giải:
Ta sẽ thấy xuất hiện kết tủa trắng của CaCO3 do xảy ra phản ứng
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3↓ + 2H2O
Đáp án A
Bài 3 trang 119 SGK Hóa Học 12: Cho 2,84 gam hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của 2 muối (CaCO3, MgCO3) trong hỗn hợp là
A. 35,2% và 64,8%. B. 70,4% và 29,6%.
C. 85,49% và 14,51%. D. 17,6% và 82,4%.
Phương pháp giải:
Gọi số mol của CaCO3 và MgCO3 lần lượt là x, y (mol)
PTHH:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
x x (mol)
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
y y (mol)
Giải hệ 2 ẩn 2 phương trình
Lời giải:
Gọi số mol của CaCO3 và MgCO3 lần lượt là x, y (mol)
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
x x (mol)
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
y y (mol)
=> %mCaCO3 = .100% =70,4%
%mMgCO3 = 100% - 70,4% = 29,6%
Đáp án B
Bài 4 trang 119 SGK Hóa Học 12: Cho 2 gam một kim loại thuộc nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55 gam muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be; B. Mg;
C. Ca; D. Ba
Phương pháp giải:
Gọi kim loại cần tìm là M
Viết PTHH: M + 2HCl → MCl2 + H2
mmuối = mKL + mCl-
=> mCl- = mmuối - mKL
=> nCl- = ?
=>nM = ? => M = ?
Lời giải:
Cách 1:
M + 2HCl → MCl2 + H2
mmuối = mKL + mCl-
=> nCl- trong muối = = 0,1 (mol)
=>nM = 1/2 .nCl- = 0,05 (mol)
=> M = = 40 (g/mol)
Kim loại là Ca.
Cách 2:
Gọi M là kim loại nhóm II, số mol là x
M + 2HCl MCl2 + H2
Theo đề bài ra ta có hệ phương trình:
Vậy M là Ca
Đáp án C
Bài 5 trang 119 SGK Hóa Học 12: Cho 2,8 gam CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2 (đktc) vào dung dịch A.
a)Tính khối lượng kết tủa thu được.
b)Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
Phương pháp giải:
Đổi nCaO = ? (mol); nCO2 = ?
Viết PTHH:
CaO + H2O → Ca(OH)2
Tính được nCa(OH)2 = nCaO
Lập tỉ lệ
k ≤ 1 => chỉ tạo muối CaCO3
1< k < 2 => tạo 2 muối
k ≥ 2 => chỉ tạo muối Ca(HCO3)2
Tùy giá trị k sẽ xảy ra trường hợp nào. Khi đó dựa vào số mol của chất phản ứng hết để tính toán
b) Khi đun nóng sẽ có phản ứng
Ca(HCO3)2 CaCO3 + CO2 + H2O
mCaCO3 = ?
Lời giải:
a)
Số mol CaO là
Số mol CO2 là
0,05 0,05 (mol)
0,05 0,05 0,05 (mol)
CaCO3 tạo thành 0,05 mol bị hòa tan 0,025 mol
0,025 0,025 0,025 (mol)
Số mol CaCO3 còn lại: 0,05 – 0,025 = 0,025 mol
Khối lượng CaCO3 là m = 0,025.100 = 2,5 gam
b) Khi đun nóng dung dịch:
Ca(HCO3)2 CaCO3 + CO2 + H2O
0,025 0,025 (mol)
Khối lượng kết tủa tối đa thu được là: 0,05.100 = 5 (gam).
Bài 6 trang 119 SGK Hóa Học 12: Khi lấy 14,25 gam muối clorua của một kim loại chỉ có hóa trị II và một khối lượng muối nitrat của kim loại đó có số mol bằng số mol muối clorua thì thấy khác nhau 7,95 gam. Xác định tên kim loại.
Phương pháp giải:
Gọi công thức của 2 muối là MCl2 và M(NO3)2
Đặt nMCl2 = nM(NO3)2 = x (mol)
Sự chênh lệch khối lượng là do gốc NO3- so với gốc Cl-
Ta có: mM(NO3)2 - mMCl2 = 7,95
=> (M + 124).x – (M + 71).x = 7,95
=> 53x = 7,95
=> x = ? (mol)
=> M =?
Lời giải:
Gọi công thức của 2 muối là MCl2 và M(NO3)2
Đặt nMCl2 = nM(NO3)2 = x (mol)
Cách 1:
Sự chênh lệch khối lượng là do gốc NO3- so với gốc Cl-
Ta có: mM(NO3)2 - mMCl2 = 7,95
=> (M + 124).x – (M + 71).x = 7,95
=> 53x = 7,95
=> x = 0,15 (mol)
=> MMCl2= = 95 (g/mol) => MM = 95 - 71 = 24 (g/mol)
Cách 2:
Theo bài ra ta có hệ phương trình:
Kim loại M là Mg.
Vậy hai muối là MgCl2 và Mg(NO3)2.
Bài 7 trang 119 SGK Hóa Học 12: Hòa tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít CO2 (đktc).
Xác định khối lượng mỗi muối trong hỗn hợp.
Phương pháp giải:
Gọi số mol của CaCO3 và MgCO3 trong hỗn hợp là x, y.
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
Ta có hệ phương trình:
=> Khối lượng mỗi muối
Lời giải:
Gọi số mol của CaCO3 và MgCO3 trong hỗn hợp là x, y.
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
Ta có hệ phương trình:
=>m CaCO3 = 0,04.100 = 4 (gam)
mMgCO3 = 84.0,05 = 4,2 (gam).
Bài 8 trang 119 SGK Hóa Học 12: Trong một cốc nước có chứa 0,01 mol Na+, 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3-, 0,02 mol Cl-. Nước trong cốc thuộc loại nào?
A. Nước cứng có tính cứng tạm thời.
B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần.
D. Nước mềm.
Phương pháp giải:
Có 3 loại nước:
+ Nước cứng tạm thời chứa: Ca2+, Mg2+, HCO3-
+ Nước cứng vĩnh cửu chứa: Ca2+, Mg2+, SO42-, Cl-
+ Nước cứng toàn phần chứa:Ca2+, Mg2+, HCO3-, SO42-, Cl-
Lời giải:
Cốc nước trên chứa các ion: Ca2+, Mg2+, HCO3-, Cl-
=> Thuộc nước cứng toàn phần
Đáp án C
Bài 9 trang 119 SGK Hóa Học 12: Viết phương trình hóa học của phản ứng để giải thích việc dùng Na3PO4 làm mềm nước cứng có tính cứng toàn phần
Lời giải:
Các PTHH:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2 ↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2 ↓ + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2 ↓ + 6NaCl
3CaSO4 +2Na3PO4 → Ca3(PO4)2 ↓ + 3Na2SO4.
Khi đó tất cả các ion Ca2+, Mg2+ đều kết tủa hết dưới dạng muối photphat => làm mềm được nước cứng toàn phần.
Lý thuyết Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúngA. KIM LOẠI KIỀM THỔ
I. VỊ TRÍ VÀ CẤU TẠO
- Kim loại kiềm thổ là những nguyên tố s (ns2) thuộc nhóm IIA, gồm các kim loại:
Beri Magie Canxi Stronti Bari
=> Trong mỗi chu kì, các kim loại kiềm thổ đứng sau kim loại kiềm.
2. Cấu tạo.
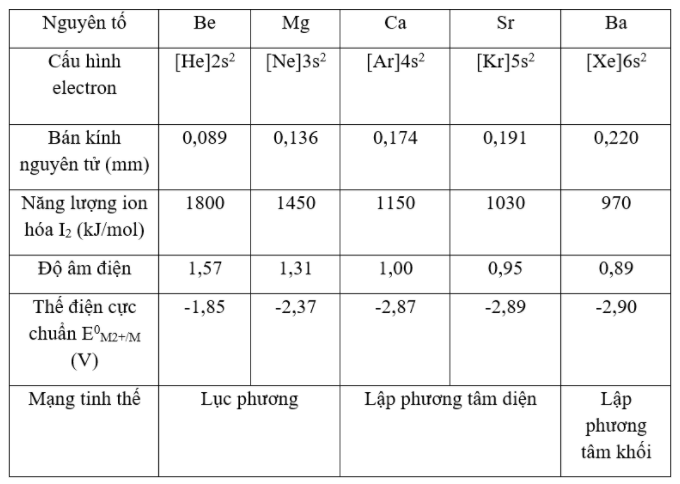
II. TÍNH CHẤT VẬT LÍ
- Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp
- Do cấu tạo mạng tinh thể của các nguyên tố khác nhau nên nhiệt độ nóng chảy, nhiệt độ sôi không thay đổi dựa theo điện tích hạt nhân
- Là những chất rắn màu trắng bạc hoặc xám nhạt, có ánh bạc, dẫn điện, dẫn nhiệt tốt.
- Độ cứng: kim loại kiềm thổ cứng hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp; độ cứng giảm dần từ Be → Ba (Be cứng nhất có thể vạch được thủy tinh; Ba chỉ hơi cứng hơn chì).
- Khối lượng riêng tương đối nhỏ, độ cứng tuy cao hơn kim loại kiềm nhưng vẫn nhỏ hơn nhôm.
III. TÍNH CHẤT HÓA HỌC
- Kim loại kiềm thổ có 2e lớp ngoài cùng trong cấu hình e
=> có xu hướng nhường 2 e khi tham gia phản ứng hóa học
M – 2e → M2+
=> Kim loại kiềm thổ có tính khử mạnh.
1. Tác dụng với phi kim
- Ở to thường, Be và Mg bị oxi hóa chậm tạo thành lớp màng oxit bảo vệ, các kim loại còn lại tác dụng với mạnh hơn.
- Khi đốt nóng tất cả các kim loại nhóm IIA đều cháy thành oxit.
2Mg + O2 → 2MgO
- Với halogen: phản ứng dễ dàng ở nhiệt độ thường: M + X2 → MX2
Ví dụ:
Ca + Cl2 → CaCl2
- Với phi kim kém hoạt động phải đun nóng
2. Tác dụng với axit
a) Tác dụng với HCl, H2SO4 loãng
Ca + 2HCl → CaCl2 + H2
b) Tác dụng với HNO3, H2SO4 đặc
- Khử N+5, S+6 thành các hợp chất mức oxi hoá thấp hơn
4Ca + 10HNO3 (l) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Mg + 4HNO3 đ → Mg(NO3)2 + 2NO2 + 2H2O
3. Tác dụng với nước
- Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch bazơ:
Ca + 2H2O → Ca(OH)2 + H2
- Mg không tan trong nước lạnh, tan chậm trong nước nóng tạo thành MgO.
Mg + H2O MgO + H2
IV. ỨNG DỤNG
- Kim loại Be được dùng làm chất phụ gia để chế tạo những hợp kim có tính đàn hồi cao, bền chắc, không bị ăn mòn.
- Kim loại Mg dùng để chế tạo những hợp kim có đặc tính cứng, nhẹ, bền. Những hợp kim này được dùng để chế tạo máy bay, tên lửa, ôtô,... Kim loại Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hoá dùng để chế tạo chất chiếu sáng ban đêm.
- Kim loại Ca dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép. Canxi còn được dùng để làm khô một số hợp chất hữu cơ.
V. ĐIỀU CHẾ
Điện phân nóng chảy muối kim loại kiềm thổ
CaCl2 Ca + Cl2
B. MỘT SỐ HỢP CHẤT CỦA CANXI
I. CANXI HIDROXIT: Ca(OH)2
- Tính chất vật lý: là chất rắn màu trắng, ít tan trong nước
- Tính chất hóa học: Mang đầy đủ tính chất của một dung dịch kiềm (tác dụng với axit, oxit axit, muối)
II. CANXI CACBONAT CaCO3
- Tính chất vật lý: chất rắn màu trắng, không tan trong nước
- Tính chất hóa học : đây là muối của axit yếu, không bền nên tác dụng được với nhiều axit vô cơ, giải phóng khí cacbonic :
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CaCO3 + 2CH3COOH → Ca(CH3COO)2 + H2O + CO2
+ Canxi cacbonat tan dần trong nước có chứa khí cacbon dioxit, tạo ra muối tan là canxi hidrocacbonat (Ca(HCO3)2):
CaCO3 + H2O + CO2 Ca(HCO3)2
=> Phản ứng thuận: Giải thích sự xâm thực của nước mưa đối với đá vôi
+ Phản ứng nghịch: Giải thích sự hình thành thạch nhũ có trong hang động.
III. CANXI SUNFAT: CaSO4
Tính chất:
- Canxi sunfat là chất rắn, màu trắng, tan ít trong nước (độ tan ở 25oC là 0,15 g/100 gam H2O).
- Tuỳ theo lượng nước kết tinh trong muối canxi sunfat, ta có 3 loại :
+ CaSO4.2H2O có trong tự nhiên là thạch cao sống, bền ở nhiệt độ thường.
+ CaSO4.H2O hoặc CaSO4.0,5H2O là thạch cao nung
+ CaSO4 có tên là thạch cao khan: không tan và không tác dụng với nước.
IV. NƯỚC CỨNG
- Định nghĩa: Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. Nước chứa ít hoặc không chứa các ion trên được gọi là nước mềm.
- Phân loại:
+ Nước cứng tạm thời: là nước có chứa các ion: Ca2+, Mg2+, HCO3-
+ Nước cứng vĩnh cửu: là nước có chứa các ion: Ca2+, Mg2+, SO42-, Cl-
+ Nước cứng toàn phần: là nước có cả tính cứng tạm thời và tính cứng vĩnh cửu
=> Nước tự nhiên thường là nước cứng toàn phần.
- Tác hại của nước cứng:
+ Làm giảm bọt, giảm khả năng tẩy rửa của xà phòng, khiến thức ăn lâu chín và giảm mùi vị.
+ Nước cứng cũng gây tác hại cho các ngành sản xuất, làm hỏng nhiều dung dịch cần pha chế.
- Biện pháp làm mềm nước cứng
+ Nguyên tắc : Làm giảm nồng độ các cation Ca2+, Mg2+ trong nước cứng.
- Phương pháp kết tủa
+ Nước cứng tạm thời : Đun sôi
Ca(HCO3)2 CaCO3¯ + CO2 + H2O
Mg(HCO3)2 MgCO3¯ + CO2 + H2O
+ Nước cứng vĩnh cửu : Dùng dung dịch Na2CO3, Na3PO4.
Ca2+ + → CaCO3 ¯
3Ca2+ + → Ca3(PO4)2 ¯
- Phương pháp trao đổi ion
V. NHẬN BIẾT ION Ca2+, Mg2+ TRONG DUNG DỊCH
Để chứng minh sự có mặt của ion Ca2+, Mg2+ ta dùng dung dịch chứa muối cacbonat để tạo ra kết tủa CaCO3 hoặc MgCO3. Sau đó sục khí CO2 dư vào dung dịch, nếu kết tủa tan chứng tỏ có mặt của Ca2+ hoặc Mg2+ trong dung dịch ban đầu
Dạng 1: Lý thuyết về kim loại kiềm thổ
* Một số ví dụ điển hình
Ví dụ 1: Mô tả nào dưới đây không phù hợp các nguyên tố nhóm IIA (kim loại kiềm thổ) ?
A. Cấu hình electron lớp ngoài cùng là ns2.
B. Tinh thể có cấu trúc lục phương.
C. Gồm các nguyên tố Be, Mg, Ca, Sr, Ba.
D. Mức oxi hoá đặc trưng trong các hợp chất là +2.
Hướng dẫn giải chi tiết:
B sai, do trong nhóm IIA, Mg, Be có cấu trúc lục phương; Ca, có cấu trúc lập phương tâm diện, Ba có cấu trúc lập phương tâm khối
Đáp án B
Ví dụ 2: Kim loại kiềm thổ có nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng biến đổi không theo một quy luật nhất định như kim loại kiềm là do
A. kiểu mạng tinh thể khác nhau.
B. bán kính nguyên tử khác nhau.
C. lực liên kết kim loại yếu.
D. bán kính ion khá lớn.
Hướng dẫn giải chi tiết:
Kim loại kiềm thổ có nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng biến đổi không theo một quy luật nhất định như kim loại kiềm là do chúng có kiểu mạng tinh thể khác nhau.
Đáp án A.
Ví dụ 3: Cho các chất sau : NaCl, Ca(OH)2, Na2CO3, HCl, NaHSO4. Số chất có thể làm mềm nước cứng tạm thời là :
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải chi tiết:
Chất có thể làm mềm nước ứng tạm thời là Ca(OH)2; Na2CO3
Đáp án B
Dạng 2: Bài toán kim loại kiềm thổ tác dụng với phi kim, nước
* Một số ví dụ điển hình:
Ví dụ 1: Cho V lít hỗn hợp khí Cl2 và O2 (đktc) tác dụng vừa đủ với hỗn hợp chứa 2,7 gam Al và 3,6 gam Mg, thu được 22,1 gam sản phẩm rắn X. Giá trị của V là :
A. 1,12 lít.
B. 3,36 lít.
C. 5,6 lít.
D. 4,48 lít.
Hướng dẫn giải chi tiết:
Ta có sơ đồ phản ứng như sau:
Áp dụng đinh luật bảo toàn khối lượng vào hệ trên ta có:
m O2 + m Cl2 = m X – m KL
=> m O2 + m Cl2 = 22,1 – 2,7 – 3,6 = 15,8 gam
Gọi số mol O2, Cl2 lần lượt là x, y mol
Áp dụng định luật bảo toàn electron
=> 3 . nAl + 2 . nMg = 4 . n O2 + 2. n Cl2
=> 3 . 0,1 + 2 . 0,15 = 4x + 2y
=> 4x + 2y = 0,6 (I)
Tổng khối lượng của hỗn hợp khí bằng 16,5 gam
=> 32x + 71y = 16,5 (II)
Từ (I) và (II) => x = 0,05; y = 0,2
=> Số mol hỗn hợp khí là: 0,05 + 0,2 = 0,25 (mol)
=> V hỗn hợp khí = 0,25 . 22,4 = 5,6 lít
Đáp án C
Ví dụ 2: Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Kim loại M là :
A. Mg.
B. Ca.
C. Be.
D. Cu.
Hướng dẫn giải chi tiết:
Số mol hỗn hợp khí tham gia phản ứng là: 5,6 : 22,4 = 0,25 mol
Ta có:
KL + O2, Cl2 sinh ra hỗn hợp chất rắn
=> m O2 + m Cl2 = 23 – 7,2 = 15,8
Gọi số mol O2, Cl2 lần lượt là x, y mol
=> Ta có hệ phương trình:
x + y = 0,25
32x + 71y = 15,8
=> x = 0,2 ; y = 0,05
Gọi hóa trị của M trong hợp chất là x
Áp dụng định luật bảo toàn electron ta có:
x . n M = 2. n Cl2 + 4. n O2
=> x . (7,2 :M) = 0,2 .2 + 0,05 . 4
=> M = 12n
=> M là Mg
Đáp án A.
Ví dụ 3: Hoà tan hoàn toàn 2,9 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 500 ml dung dịch chứa một chất tan có nồng độ 0,04M và 0,224 lít khí H2 (đktc). Kim loại M là
A. Ca.
B. K.
C. Na.
D. Ba.
Hướng dẫn giải chi tiết:
Ta có sơ đồ phản ứng :
(M, M2On) + H2O → M(OH)n + H2 (1)
mol: (0,01n + 0,01) 0,02 0,01
Áp dụng định luật bảo toàn nguyên tố đối với H ta suy ra
n H2O = (0,01n + 0,01) mol
Mặt khác, áp dụng định luật bảo toàn khối lượng ta có :
2,9 + 18(0,01n + 0,01) = 0,02(M + 17n) + 2.0,01
0,02M + 0,16n = 3,06 =>
Vậy kim loại M là Ba.
Đáp án D.
Dạng 3: Kim loại kiềm thổ tác dụng với dung dịch axit
Ví dụ 1: Hoà tan hoàn toàn một lượng kim loại R hóa trị n bằng dung dịch H2SO4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hoà tan. Kim loại R đó là :
A. Al.
B. Ba.
C. Zn.
D. Mg.
Hướng dẫn giải chi tiết:
Giả sử số mol R tham gia phản ứng là 1 mol
1 mol R tác dụng với H2SO4 tạo ra 0,5 mol R2(SO4)n
Ta có phương trình:
0,5 . (2R + 96n) = 5R => R = 12n
Vậy n = 2, R = 24 => R là Mg
Đáp án D
Ví dụ 2: Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hoá trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là :
A. Ba.
B. Ca.
C. Be.
D. Mg.
Hướng dẫn giải chi tiết:
Khối lượng mol trung bình của hỗn hợp (R, RO) là: 6,4 : 0,2 = 32 gam/mol
=> R < 32 < R + 16 => 16 < R < 32
=> R là Mg
Đáp án D
Dạng 4: Kim loại kiềm thổ tác dụng với dung dịch muối
* Một số ví dụ điển hình:
Ví dụ 1: Cho a mol kim loại Mg vào dung dịch hỗn hợp chứa b mol CuSO4 và c mol FeSO4. Kết thúc phản ứng dung dịch thu được chứa 2 muối. Xác định điều kiện phù hợp cho kết quả trên.
A. a b.
B. b a < b +c.
C. b a b +c.
D. b < a < 0,5(b + c).
Hướng dẫn giải chi tiết:
Thứ tự phản ứng khi cho Mg vào dung dịch trên là:
Mg + Cu2+ → Mg2+ + Cu (1)
Mg + Fe2+ → Mg2+ + Fe (2)
=> Theo đề bài, sau phản ứng thu được 2 dung dịch chứa 2 muối
=> 2 muối là Mg2+ và Fe2+
Trong dung dịch có muối Fe2+ nên số mol e mà Mg nhường nhỏ hơn số mol electron mà Cu2+ và Fe2+ nhận
=> 2 n Mg < 2 n Cu2+ + 2 n Fe2+
=> a < b + c
Dung dịch sau phản ứng chứa Mg2+ và Fe2+ nên (1) đã xảy ra hoàn toàn, (2) có thể xảy ra hoặc chưa xảy ra, nên số mol electron mà Mg nhường lớn hơn hoặc bằng số mol electron mà Cu2+ nhận, suy ra : (**)
Vậy b a < b +c.
Đáp án B.
Ví dụ 2: Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là :
A. 2,88.
B. 2,16.
C. 4,32.
D. 5,04.
Hướng dẫn giải chi tiết:
Ta có phương trình
Mg + 2Fe3+ → Mg2+ + 2Fe2+ (1)
Mg + Fe2+ → Mg2+ + Fe (2)
3,36 < 0,12 . 56 = 6,72
=> Sau phản ứng dung dịch muối chưa phản ứng hết
n Fe sinh ra sau phản ứng = 3,36 : 56 = 0,06 (mol)
(2) n Fe = n Mg = 0,06 (mol)
(1) n Mg = ½ n FeCl3 = 0,06 (mol)
=> n Mg = 0,06 + 0,06 = 0,12 (mol)
=> m Mg = 0,12 . 24 = 2,88 gam.
Đáp án A.

