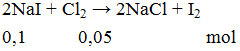Chúng tôi xin giới thiệu phương trình 2NaI + Cl2 → 2NaCl + I2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình 2NaI + Cl2 → 2NaCl + I2
1. Phương trình phản ứng hóa học:
2NaI + Cl2 → 2NaCl + I2
2. Hiện tượng nhận biết phản ứng
- sản phẩm sinh ra làm xanh hồ tinh bột.
3. Điều kiện phản ứng
- điều kiện thường.
4. Tính chất hóa học
- Natri iodide phản ứng với axit sulphuric dẫn đến sự hình thành hydro iodide và natri bisulfit. Phương trình hóa học được đưa ra dưới đây.
NaI + H2SO4 → HI + NaHSO4
- Natri iốt phản ứng với clo, trong đó clo thay thế iốt tạo thành natri clorua và iốt. Phương trình hóa học được đưa ra dưới đây.
Cl2 + 2NaI → 2 NaCl + I2
5. Cách thực hiện phản ứng
- dẫn khí Cl2 vào ống nghiệm chứa NaI và vài giọt hồ tinh bột.
6. Bạn có biết
- Phản ứng này chứng minh tính oxi hóa clo mạnh hơn iot.
7. Bài tập liên quan
Ví dụ 1: Phản ứng nào chứng minh clo có tính oxi hóa mạnh hơn iot?
A. Lần lượt cho clo, iot phản ứng với NaF.
B. Cho clo, iot phản ứng với nước.
C. Dẫn khí Clo đi qua dung dịch NaI có sẵn vài giọt hồ tinh bột.
D. Cho NaCl, NaI phản ứng với AgNO3.
Hướng dẫn giải
2NaI + Cl2 → 2NaCl + I2
Đáp án C.
Ví dụ 2: Dẫn từ từ khí clo qua bình đựng NaI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là
A. Dung dịch hiện màu vàng nâu.
B. Dung dịch hiện màu xanh.
C. Dung dịch có màu trắng.
D. Có kết tủa màu vàng nhạt.
Hướng dẫn giải
2NaI + Cl2 → 2NaCl + I2
I2 sinh ra làm xanh hồ tinh bột.
Đáp án B.
Ví dụ 3: Thể tích khí Cl2 ở đktc cần dung để phản ứng vừa đủ với 0,1 mol NaI là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,05.22,4 = 1,12 lít.
Đáp án A.
8. Một số phương trình phản ứng hóa học khác của Natri và hợp chất:
2NaI + O3 + H2O → 2NaOH + I2 + O2↑
2NaI + 2FeCl3 → I2 + 2FeCl2 + 2NaCl
2NaI + 2Fe(NO3)3 → I2 + 2Fe(NO3)2 + 2NaNO3