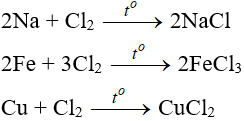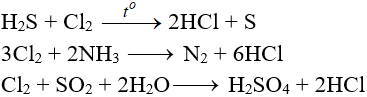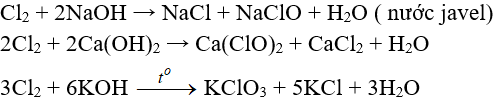Chúng tôi xin giới thiệu phương trình 2Ag + Cl2 → 2AgCl ↓ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Bạc. Mời các bạn đón xem:
Phương trình 2Ag + Cl2 → 2AgCl↓
1. Phương trình phản ứng hóa học:
2Ag + Cl2 → 2AgCl ↓
2. Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa trắng
3. Điều kiện phản ứng
- Ở nhiệt độ cao
4. Tính chất hoá học
a. Tính chất hoá học của Ag
- Bạc kém hoạt động. Ag → Ag+ + 1e
Tác dụng với phi kim
- Bạc không bị oxi hóa trong không khí dù ở nhiệt độ cao.
Tác dụng với ozon
2Ag + O3 → Ag2O + O2
Tác dụng với axit
- Bạc không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3hoặc H2SO4 đặc, nóng.
3Ag + 4HNO3 (loãng) → 3AgNO3 + NO + 2H2O
2Ag + 2H2SO4 (đặc, nóng) → Ag2SO4 + SO2 + 2H2O
Tác dụng với các chất khác
- Bạc có màu đen khi tiếp xúc với không khí hoặc nước có mặt hidro sunfua:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
- Bạc tác dụng được với axit HF khi có mặt của oxi già:
2Ag + 2HF (đặc) + H2O2 → 2AgF + 2H2O
2Ag + 4KCN (đặc) + H2O2 → 2K[Ag(CN)2] + 2KOH
b. Tính chất hoá học của Cl2
Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
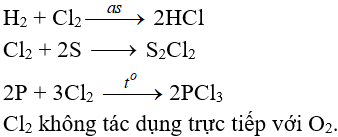
Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
Tác dụng với chất khử khác
Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
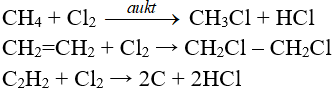
5. Cách thực hiện phản ứng
- Cho bạc tác dụng với khí clo
6. Bạn có biết
- Ag là kim loại có tính khử yếu nên khi tác dụng với các chất có tính oxi hóa mạnh như Cl2...ở nhiệt độ cao
7. Bài tập liên quan
Ví dụ 1: Khi cho bạc tác dụng với khí clo sẽ tạo thành màu gì ?
A. Kết tủa màu trắng
B. Kết tủa màu vàng
C. Kết tủa màu đen
D. Kết tủa màu nâu đỏ
Đáp án: A
Ví dụ 2: Cho 1,08 g bạc tác dụng với khí Clo thì thu được m(g) kết tủa . Giá trị của m là:
A. 2,15 g
B. 0,7175 g
C. 2,87 g
D. 1,435 g
Hướng dẫn:
2Ag + Cl2 → 2AgCl↓
Ta có: nAg = 1,08/108 = 0,01 (mol)
Theo phương trình: nAgCl = nAg = 0,01 (mol)
→ mAgCl = 0,01. 143,5 = 1,435 (g)
Đáp án: D
Ví dụ 3: Trong phản ứng: 2Ag + Cl2 → 2AgCl↓. Chọn phát biểu đúng:
A. Ag là chất khử
B. Ag là chất oxi hóa
C. Ag vừa là chất khử, vừa là chất oxi hóa
D. Ag không là chất khử, cũng không là chất oxi hóa
Đáp án: A
8. Một số phương trình phản ứng hoá học khác của Bạc (Ag) và hợp chất: