Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 4: Luyện tập Este và chất béo chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Luyện tập Este và chất béo lớp 12.
Bài giảng Hóa học 12 Bài 4: Luyện tập Este và chất béo
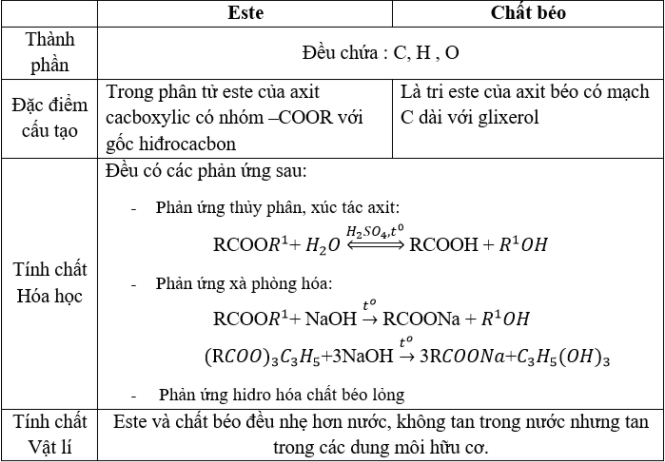

Este có thể có công thức cấu tạo nào sau đây?
Hỗn hợp axit stearic (C17H35COOH) và axit panmitic (C15H31COOH) theo tỉ lệ 2 : 1 nên este có 2 gốc C17H35COO và 1 gốc C15H31COO
Đáp án B
a) Tìm công thức phân tử của A.
b) Thực hiện phản ứng xà phòng hóa 7,4 gam A với dung dịch NaOH khi đến phản ứng hoàn toàn thu được sản phẩm có 6,8 gam muối. Tìm công thức cấu tạo và tên gọi của A.
a)
- Công thức tổng quát của este no, đơn chức là CnH2nO2 (n≥2)
- Từ nO2=nA => MA => n
b) Este đơn chức nên ta có: n muối = n este => M muối => CTCT của muối => CTCT este
a) Vì A là este no, đơn chức nên có công thức phân tử là CnH2nO2 (n≥2)
Ta có (mol)
=> MA = 7,4/0,1 = 74 =>14n+32 = 74 => n = 3
=> Công thức phân tử của A là C3H6O2
b)
Gọi CTPT của A là
+ NaOH -> +
Theo pt: số mol = số mol A = 0,1 mol
M(R1COONa ) = + 67 = 68 → = 1
→ là H (hay muối là HCOONa)
→ CTCT của A là: HCOOC2H5 (etyl format).
Tính giá trị của a, m. Viết công thức cấu tạo có thể có của X.
Tính số mol của glixerol và natri lioleat => CTCT của X => nC17H33COONa => m
- nX = nglixerol => a
Cách 1:
(mol) ; (mol).
=> CTCT của X là C17H31COOC3H5(C17H33COO)2
=> (mol) => m = 0,02.304 = 6,08 (gam)
Ta luôn có: nX = nglixerol = 0,01 mol
=> a = 0,01.882 = 8,82 (gam)
+ Cách 2:
PTHH tổng quát: (RCOO)3C3H5 + 3NaOH → 3RCOONa + C3H5(OH)3
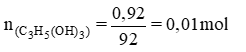
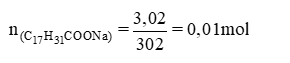
⇒ = 0,03 – 0,01 = 0,02 mol
⇒ m = = 0,02. 304 = 6,08(g)
mNaOH = 0,03. 40 = 1,2 g
BTKL ⇒ a = meste = mmuối + mglixerol - NaOH = 6,08 + 3,02 + 0,92 - 1,2 = 8,82g
Tỉ lệ : = 0,01 : 0,02 = 1:2
⇒Có 2 công thức cấu tạo phù hợp:

A. etyl fomat. B. etyl propionate.
C. etyl axetat. D. propyl axetat.
Khi thủy phân este đơn chức với KOH vừa đủ ta luôn có:
n este = nKOH = n ancol => M este, Mancol => CTCT este
Gọi CTPT của este là RCOOR1
Số mol KOH nKOH = 0,1.1 = 0,1 (mol)
RCOOR1 + KOH -> RCOOK + R1OH
Theo pt: = nKOH = 0,1 mol.
Ta có:
CTCT của este là: CH3COOC2H5 (etyl axetat)
Đáp án C
A. C2H4O2. B. C3H6O2.
C. C4H8O2. D. C5H8O2.
nCO2 => nC
nH2O => nH
mO=mX-mC-mH => nO
=> Tỉ lệ C:H:O => CTĐGN => CTPT
nCO2 = 3,36/22,4 = 0,15 mol => nC = 0,15 mol
nH2O = 2,7/18 = 0,15 mol => nH = 0,3 mol
mO=mX-mC-mH = 3,7 - 0,15.12 - 0,3.1 = 1,6 gam => nO= 0,1 mol
=> Tỉ lệ C:H:O = 0,15:0,3:0,1=3:6:2
=> CTĐGN C3H6O2
Mà este là đơn chức (chứa 2 nguyên tử O) => CTPT của X là C3H6O2
Đáp án B
A. 22%. B. 42,3%.
C. 57,7%. D. 88%.
Đặt số mol mỗi chất trong X là x, y
Lập hệ 2 phương trình 2 ẩn dựa vào dữ kiện đề bài:
+ mX
+ nNaOH
Gọi số mol của CH3COOH và CH3COOC2H5 là x, y
CH3COOH + NaOH -> CH3COONa
CH3COOC2H5 + NaOH -> CH3COONa + C2H5OH.
nNaOH =![]()
Ta có hệ phương trình :
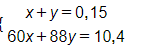
=> x = 0,1 ; y = 0,05.
%metyl axetat = 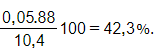
Đáp án B
A. ESTE
I. ĐỊNH NGHĨA
- Khi thay thế nhóm OH ở nhóm COOH của axit bằng gốc OR ta thu được este
* Công thức tổng quát
+ Este được tạo bởi axit cacboxylic no, đơn chức mạch hở và ancol no, đơn chức, mạch hở (este no, đơn chức, mạch hở): CmH2m+1COOCm’H2m’+1 hay CnH2nO2 (m ≥ 0; m’ ≥ 1; n ≥ 2 ).
+ Este đa chức được tạo bởi axit cacboxylic đa chức và ancol đơn chức: R(COOR’)n
+ Este đa chức được tạo bởi axit cacboxylic đơn chức và ancol đa chức: (RCOO)nR’
+ Este đa chức được tạo bởi axit cacboxylic đa chức và ancol đa chức (cùng có n nhóm chức): R(COO)nR’
+ Tóm lại, có thể đặt CTTQ của este : CxHyOz (x, z ≥ 2; y là số chẵn, y ≤ 2x)
II. DANH PHÁP
Tên gốc hiđrocacbon R’ + tên anion gốc axit (đuôi “at”)
HCOOC2H5: etyl fomat CH3COOCH=CH2: vinyl axetat
III. TÍNH CHẤT VẬT LÝ:
- Nhiệt độ sôi thấp hơn axit, ancol vì không tạo liên kết hiđro
- Thường: lỏng, nhẹ hơn nước, ít tan trong nước
- Hòa tan nhiều hợp chất hữu cơ
- Thường có mùi thơm dễ chịu: isoamyl axetat: mùi chuối chín; etyl butirat: mùi dứa, etyl isovalerat: mùi táo
IV. TÍNH CHẤT HÓA HỌC
1. Thủy phân môi trường axit (thuận nghịch)
R-COO-R’ + H-OH R-COOH + R’-OH
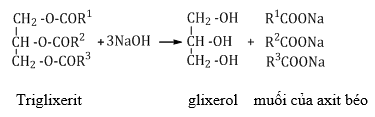
2. Thủy phân môi trường kiềm ( phản ứng xà phòng hóa)
R-COO-R’ + NaOH R-COONa + R’-OH
a) Tạo ancol: CH3COOCH3 + NaOH → CH3COONa + CH3OH
b) Tạo anđehit: RCOOCH=CH-R’ + NaOH → RCOONa + R’-CH2CH=O
c) Tạo xeton : RCOOC(R’)=CH-R” + NaOH → RCOONa + R’-CO-CH2R”
d) Tạo phenolat: RCOOC6H4R’ + 2NaOH → RCOONa + R’-C6H5ONa + H2O
3. Phản ứng tráng bạc của HCOOR
HCOOR + 2AgNO3 + 3NH3 + H2O → ROCOONH4 + 2Ag↓ + 2NH4NO3
+ Nếu nNaOH phản ứng = nEste => Este đơn chức
+ Nếu RCOOR’ (este đơn chức), trong đó R’ là C6H5– hoặc vòng benzen có nhóm thế
=> nNaOH phản ứng = 2.neste và sản phẩm cho 2 muối, trong đó có phenolat:
VD: RCOOC6H5 + 2NaOH → RCOONa + C6H5ONa + H2O
+ Nếu nNaOH phản ứng = a.neste (a > 1 và R’ không phải C6H5– hoặc vòng benzen có nhóm thế) => Este đa chức
+ Nếu phản ứng thuỷ phân este cho 1 anđehit (hoặc xeton), ta coi như ancol (đồng phân với andehit) có nhóm –OH gắn trực tiếp vào liên kết C=C vẫn tồn tại để giải và từ đó => CTCT của este.
+ Nếu sau khi thủy phân thu được muối (hoặc khi cô cạn thu được chất rắn khan) mà mmuối = meste + mNaOH thì este phải có cấu tạo mạch vòng
Dạng 2: Bài toán về phản ứng este hóa
R-COOH + R’-OH R-COO-R’ + H-OH
Đặc điểm của phản ứng este hóa là thuận nghịch nên có thể gắn với các bài toán:
+) Tính hằng số cân bằng K:
+) Tính hiệu suất phản ứng este hóa:
![]()
+) Tính lượng este tạo thành hoặc axit cacboxylic cần dùng
Dạng 3: Bài toán về phản ứng đốt cháy este
- CTTQ: CxHyOz. x, y, z nguyên dương, x ≥ 2, z ≥ 2
- Phản ứng cháy: CxHyOz + ( ) O2 → xCO2 + y/2 H2O
- Nếu đốt cháy một este mà thu được <=> Este no, đơn chức, mạch hở.
- Nếu đốt cháy một este đơn chức mà thu được => Este không no
Ancol isoamylic isoamyl axetat
2. Este của phenol
Anhiđrit axetic phenyl axetat
3. Vinyl axetat
CH3COOH + CH≡CH CH3COOCH=CH2
VI. ỨNG DỤNG:
- Dung môi hữu cơ
- Trùng hợp vinyl axetat: chất dẻo hoặc thủy phân tạo poli(vinyl ancol)
- Trùng hợp metyl acrylat; metyl metacrylat: Thủy tinh hữu cơ
- Este có mùi thơm: Công nghiệp thực phẩm, mĩ phẩm
B. LIPIT
I. ĐỊNH NGHĨA
Lipit: Hợp chất hữu cơ có trong tế bào sống, không tan trong nước nhưng tan trong dung môi hữu cơ không phân cực như ete, xăng dầu…
Axit béo: axit monoaxitcacboxylic có số C chẵn từ 12C ÷ 24C, không phân nhánh
+ No: axit panmitic (C15H31COOH; k = 1); axit stearic (C17H35COOH; k = 1)
+ Không no: axit oleic (C17H33COOH; k = 2); axit linoleic (C17H31COOH; k = 3)
II. TÍNH CHẤT VẬT LÝ
- Triglixerit chứa chủ yếu gốc axit béo no: rắn như mỡ động vật
- Triglixerit chứa chủ yếu gốc axit béo không no (dầu) : lỏng
- Chất béo: Nhẹ hơn nước, không tan trong nước, tan trong các dung môi hữu cơ như benzen, xăng, ete
III. TÍNH CHẤT HÓA HỌC
a. Thủy phân trong môi trường axit
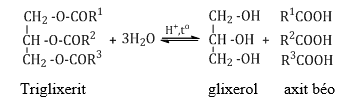
b. Thủy phân trong môi trường kiềm (phản ứng xà phòng hóa)
c. Phản ứng hiđro hóa
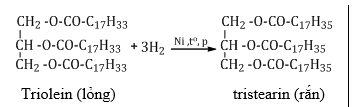
* Phương pháp giải
- BTKL: m xà phòng+ m glixerol = m chất béo + m NaOH
- Số trieste tối đa tạo bởi glixerol và n gốc axit béo:
- Xà phòng hóa chất béo bằng NaOH (KOH): nchất béo = nglixerol = 1/3.nNaOH
- Hiệu suất

