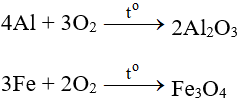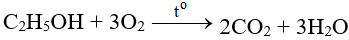Chúng tôi xin giới thiệu phương trình Al + O2 → Al2O3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình Al + O2 → Al2O3
1. Phương trình phản ứng hóa học
4Al + 3O2 → 2Al2O3
2. Hiện tượng nhận biết phản ứng.
- Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
- Chất tạo thành màu trắng sáng là nhôm oxit Al2O3.
3. Điều kiện phản ứng
- Nhiệt độ
4. Giải thích
Vì ở điều kiện nhiệt độ này xảy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong phản ứng hóa học: nhôm đóng vai trò là chất khử.
5. Tính chất hóa học
5.1. Tính chất hóa học của Al
- Tác dụng với oxi và một số phi kim.
4Al + 3O2→ 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
- Tác dụng với axit (HCl, H2SO4loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3đặc, nguội
- Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
- Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
- Tính chất hóa học riêng của nhôm.
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
- Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Cr2O3 + 2Al→ Al2O3 + 2Cr
5.2. Tính chất hóa học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
a. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
b. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
c. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Cách thực hiện phản ứng
- Rắc bột nhôm trên ngọn lửa đèn cồn.
7. Bạn có biết
- Nhôm cháy trong oxi tạo thành Al2O3. Ở điều kiện thu7o2ng, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước.
8. Bài tập liên quan
Câu 1. Cách nào sau đây không phá hủy các đồ dung bằng nhôm?
A. Dùng nước chanh để làm sạch bề mặt bằng nhôm
B. Rửa sach, lau khô và để chỗ khô ráo
C. Dùng đồ làm bằng nhôm để đựng nước vôi
D. Dùng đồ làm bằng nhôm để đựng nước biển
Lời giải:
B. Rửa sạch, lau khô và để chỗ khô ráo
A, C, D là làm ăn mòn đồ nhôm
Câu 2. Có 3 kim loại Al, Ca, Mg. Chỉ cần dùng thuốc thử nào sau đây có thể nhận ra từng kim loại?
A. dung dịch H2SO4
B. Dung dịch Ba(OH)2
C. Nước
D. dung dịch HCl
Lời giải:
Để phân biệt 3 kim loại Al, Ca, Mg ta dùng nước. Cho nước vào 3 mẫu kim loại, kim loại tốt trong nước và sủi bọt khí là Ca, 2 kim loại không tan trong nước là Al và Mg.
Ca + 2H2O → Ca(OH)2 + H2 ↑
Lấy dung dịch Ca(OH)2 vừa thu được đổ vào mẫu 2 kim loại còn lại, kim loại nào tan, sủi bọt khí là Al, kim loại không có hiện tượng gì là Mg
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2 ↑
Câu 3. Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 5,04 lít
Lời giải:
nAl = 0,2 mol
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
0,2 mol →0,3 mol
=> VH2 = 0,3 .22,4 = 6,72 lít
Câu 4. Quặng boxit là nguyên liệu chính dùng để điều chế kim loại
A. Al
B. Fe
C. Cu
D. Zn
Lời giải:
Câu 5. Các đồ vật làm bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Lời giải:
Đồ vật làm bằng nhôm bền trong không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ.
Câu 6. Có 3 kim loại là Al, Fe và Na. Chỉ cần dùng thuốc thử nào sau đây có thể nhận ra từng kim loại?
A. Dung dịch H2SO4 đặc, nguội
B. Dung dịch Ca(OH)2
C. Nước
D. Dung dịch CuCl2
Lời giải:
Cho từng kim loại hòa tan vào nước
Kim loại không tan là Al và Fe
Na tan có khí thoát ra
Na + H2O → NaOH + H2
Dùng dung dịch NaOH nhận biết 2 kim loại Al và Fe
Kim loại nào tan dần là Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Không có hiện tượng gì là Fe
Câu 7. Cho 2,7 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 3,36 lít
Lời giải:
nAl= 0,1 mol
Phương trình phản ứng hóa học
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2
0,1 mol →0,15 mol
=> VH2 = 0,15 .22,4 = 3,36 lít
Câu 8. Nhôm và nhôm hidroxit phản ứng được với cả hai dung dịch nào sau dây?
A. Na2SO4, KOH.
B. NaOH, HCl.
C. KCl, NaNO3.
D. NaCl, H2SO4.
Lời giải:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2Al + 6HCl → 2AlCl3 + 3H2
Al(OH)3+ NaOH → NaAlO2 + 2H2O
Al(OH)3+ 3HCl → AlCl3 + 3H2O.
Câu 9. Không được dùng nồi nhôm để nấu xà phòng vì
A. phản ứng không xảy ra
B. nhôm là kim loại có tính khử mạnh
C. chất béo phản ứng được với nhôm
D. nhôm sẽ bị phá hủy trong dung dịch kiềm
Lời giải:
Phương trình phản ứng:
Ban đầu lớp nhôm oxit bị phá hủy:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Sau đó nhôm tác dụng với nước, tạo ra nhôm hidroxit và bị phá hủy trong môi trường kiềm:
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
Câu 10. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4 nung nóng.
Lời giải:
Phản ứng nhiệt nhôm là phản ứng dùng nhôm để khử các oxit kim loại yếu hơn, phản ứng nhiệt nhôm thuộc loại phản ứng oxi hóa khử trong đó nhôm là chất khử.
Al tác dụng với H2SO4 đặc, nóng không phải là phản ứng nhiệt nhôm.
9. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al + O2 → Al2O3