Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt lớp 12.
Bài giảng Hóa học 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
Giải bài tập Hóa học 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
Câu hỏi và bài tập (trang 165 SGK Hóa Học 12)
Bài 1 trang 165 SGK Hóa Học 12: Điền công thức hóa học của chất vào những chỗ trống và lập các phương trình hóa học sau :
a)Fe + H2SO4 (đặc) SO2 ↑+ …
b)Fe + HNO3 (đặc) NO2 ↑+ …
c)Fe + HNO3 (loãng) NO↑ + …
d) FeS + HNO3 → NO↑ + Fe2(SO4)3 +
Lời giải:
a) 2Fe + 6H2SO4 ( đặc) Fe2(SO4)3 + 3SO2↑ + 6H2O
b) Fe + 6HNO3 (đặc ) Fe(NO3)3+ 3NO2↑ + 3H2O
c) Fe + 4HNO3 (loãng) Fe(NO3)3 + NO ↑ + 2H2O
d) 3FeS + 12HNO3 →Fe(NO3)3+Fe2(SO4)3+ 9NO↑ + 6H2O
Bài 2 trang 165 SGK Hóa Học 12: Bằng phương pháp hóa học, hãy phân biệt ba mẫu hợp kim sau :
Al - Fe ;Al - Cu và Cu - Fe.
Lời giải:
Lấy mỗi mẫu 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
-Cho lần lượt dung dịch HCl dư vào 3 mẫu:
+ Mẫu nào có khí thoát ra và kim loại tan hết là mẫu chứa Al - Fe.
2Al + 6HCl → 2AlCl3 + H2↑
Fe + 2HCl → FeCl2 + H2↑
+ Mẫu nào có khí thoát ra, vẫn còn chất rắn không tan là mẫu chứa Al - Cu và Fe- Cu ( Do Cu là kim loại đứng sau H trong dãy điện hóa nên không phản ứng với HCl)
- Cho dung dịch NaOH dư vào mẫu Al - Cu và Fe - Cu
+ Mẫu kim loại nào có khí H2 thoát ra là Al - Cu
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
+ Mẫu còn lại không có hiện tượng gì là Fe - Cu.
Bài 3 trang 165 SGK Hóa Học 12: Một hỗn hợp gồm Al,Fe,Cu.Hãy trình bày phương pháp hóa học để tách riêng từng kim loại trong hỗn hợp đó. Viết phương trình hóa học của các phản ứng.
Lời giải:
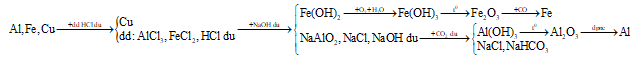
2Al + 6HCl → 2AlCl3 + 3H2↑
Fe + 2HCl → FeCl2 + H2↑
HCl dư + NaOH → NaCl + H2O
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
AlCl3 + NaOHdư → NaAlO2 + H2O
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3↓
2Fe(OH)3 Fe2O3 + 3H2O
Fe2O3 + 3CO 2Fe + 3CO2↑
NaAlO2 + CO2 + H2O → Al(OH)3↓ + NaHCO3
2Al(OH)3 Al2O3 + 3H2O
2Al2O3 4Al + 3O2↑
Bài 4 trang 165 SGK Hóa Học 12: Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch H2SO4 loãng thu được 560 ml một chất khí ở đktc. Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 thì thu được chất rắn. Tính khối lượng bột sắt đã dùng và khối lượng chất rắn thu được.
Lời giải:
Trường hợp 1:
Đối 560 ml = 0,56 lít
Số mol H2 là
Theo phương trình:
- Trường hợp 2: Lượng Fe gấp đối nên số mol Fe khi đó là 0,025.2 = 0,05 mol
Theo phương trình:
Bài 5 trang 165 SGK Hóa Học 12: Biết 2,3 gam hỗn hợp gồm MgO, CuO, FeO tác dụng vừa đủ với 100ml dung dịch H2SO4 0,2M. Khối lượng muối thu được là :
A. 3,6 gam. B. 3,7 gam.
C. 3,8 gam. D. 3,9 gam.
Phương pháp giải:
Gọi công thức chung là MO
MO + H2SO4 → MSO4 + H2O
=> nO (trong oxit) = nH2SO4= ?
=> mKL = m oxit - mO (trong oxit) =?
mmuối = mKL +
Lời giải:
Cách 1:
Gọi công thức chung là MO
MO + H2SO4 → MSO4 + H2O
=> nO (trong oxit) = nH2SO4= 0,02 (mol)
=> mKL = m oxit - mO (trong oxit)
= 2,3 - 0,02.16
=1,98 (g)
mmuối = mKL +
= 1,98 + 0,02.96
= 3,9 (g)
Cách 2:
1 mol oxit (RO) tạo ra 1 mol muối sunfat (RSO4)
khối lượng tăng là: 96 – 16 =80 gam
Khối lượng muối thu được là 2,3 + 80.0,02 = 3,9 gam
Cách 3:
2,3 gam (MgO, CuO, FeO) + 0,2 mol H2SO4 muối sunfat + H2O
Ta thấy:
Áp dụng bảo toàn khối lượng:
mmuối = 3,9 gam
Đáp án D
Bài 6 trang 165 SGK Hóa Học 12: Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron và electron là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Nguyên tố X là :
A. Sắt. B.Brom.
C. Photpho. D.Crom.
Phương pháp giải:
Gọi số pronton là p và số notron là n
Giải hệ 2 ẩn 2 phương trình
=> Tên nguyên tố
Lời giải:
Gọi số pronton là p và số notron là n.
Ta có:
=> Nguyên tử khối của X = p+ n = 56
=> X là sắt
Đáp án A
Lý thuyết Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
1. Sắt.
- Cấu hình electron : [Ar] 3d64s2.
- Dễ nhường 2e ở phân lớp 4s thể hiện số oxi hóa +2 và có thể nhường thêm 1e ở phân lớp 3d thể hiện ở số oxi hóa +3.
2. Hợp chất của sắt.
- Tính chất hóa học đặc trưng của hợp chất Fe(II) là tính khử : Fe2+ -> Fe3+ + 1e.
- Tính chất hóa học đặc trưng của hợp chất Fe(III) là tính oxi hóa :
Fe3+ + 1e -> Fe2+ ; Fe3+ + 3e -> Fe
3. Hợp kim của sắt : gang và thép.

