Chúng tôi xin giới thiệu phương trình Al2O3 + 6NaOH + 12HF → 9H2O + 2Na3AlF6 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình Al2O3 + 6NaOH + 12HF → 9H2O + 2Na3AlF6
1. Phương trình phản ứng hóa học:
Al2O3 + 6NaOH + 12HF → 9H2O + 2Na3AlF6
2. Hiện tượng nhận biết phản ứng
- Phản ứng tạo thành hợp chất criolit
3. Điều kiện phản ứng
- Nhiệt độ phòng
4. Tính chất hoá học
a. Tính chất hoá học của Al2O3
- Al2O3 là oxit lưỡng tính.
+ Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
- Al2O3 tác dụng với C
Al2O3 + 9C 
b. Tính chất hoá học của NaOH
- NaOH là một bazơ mạnh, khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein chuyển sang màu hồng.
- Phản ứng với axit tạo thành muối và nước
NaOH + HCl → NaCl + H2O
- Phản ứng với oxit axit:
2 NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2 → NaHSO3
- Phản ứng với axit hữu cơ để tạo thành muối và thủy phân este, peptit
- Phản ứng với muối tạo bazo mới và muối mới
2 NaOH + CuCl2 → 2 NaCl + Cu(OH)2
- Tác dụng với kim loại lưỡng tính
2 NaOH + 2 Al + 2 H2O → 2 NaAlO2 + 3 H2
- Tác dụng với hợp chất lưỡng tính
NaOH + Al(OH)3 → NaAlO2 + 2 H2O
2 NaOH + Al2O3 → 2 NaAlO2 + H2O
c. Tính chất hoá học của HF
Axit HF là axit yếu vì vậy nó có đầy đủ các tính chất của một axit
Tác dụng với phi kim
O2 + HF → HFO2
2I2 + HF→ HFI4
2Br2 + HF → HFBr4
Tác dụng với oxit
Tính chất đặc biệt của axit HF là tác dụng với silic đioxit (SiO2) có trong thành phần thủy tinh)
→ do đó không dùng chai lọ thủy tinh để đựng dd axit HF.
SiO2 + 4HF → 2H2O + SiF4
SO3 + HF → HSO3F
Tác dụng với nước
2H2O + HF → 2H2 + HFO2
H2O + HF + AsF5 → HAsF6.H2O
Tác dụng với bazơ
NaOH + HF → H2O + NaF
Ca(OH)2 + 2HF → CaF2 + 2H2O
Tác dụng với muối
NaF+HF↔NaHF2
5. Cách thực hiện phản ứng
- Cho Al2O3 tác dụng với dung dịch NaOH và HF
6. Bài tập liên quan
Ví dụ 1: Cho các quặng sau: pirit, thạch cao, mica, apatit, criolit, boxit, dolomit. Số quặng chứa nhôm là:
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: B
Hướng dẫn giải
Cryolit: Na3AlF6 hay AlF3.3NaF
Boxit: Al2O3.nH2O
Mica: K2O.Al2O3.6SiO2.2H2O
Ví dụ 2: Trong vỏ Trái Đất có nhiều nhôm hơn sắt nhưng giá mỗi tấn nhôm cao hơn nhiều so với giá mỗi tấn sắt. Lí do vì:
A. Chuyển vận quặng nhôm đến nhà máy xử lí tốn kém hơn vận chuyển quặng sắt
B. Nhôm hoạt động mạnh hơn sắt nên để thu hồi nhôm từ quặng sẽ tốn kém hơn
C. Nhôm có nhiều công dụng hơn sắt nên nhà sản xuất có thể có lợi nhuận nhiều hơn
D. Quặng nhôm ở sâu trong lòng đất trong khi quặng sắt từng thấy ngay trên mặt đất
Đáp án: B
Hướng dẫn giải
Vì nhôm hoạt động mạnh hơn sắt
Ví dụ 3: Al2O3 phản ứng được với cả hai dung dịch
A. NaOH và HCl.
B. KCl và NaNO3.
C. NaCl và H2SO4.
D. Na2SO4 và KOH.
Đáp án: A
Hướng dẫn giải
Al2O3 có tính lưỡng tính nên có thể tác dụng với cả NaOH và HCl
7. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Phản ứng nhiệt phân: 2Al(OH)3 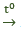
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + HNO3 → Al(NO3)3 + 3H2O

