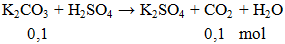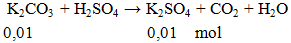Chúng tôi xin giới thiệu phương trình K2CO3 + H2SO4 → K2SO4 + CO2 + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
1. Phương trình phản ứng hóa học:
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- điều kiện thường,
4. Tính chất hóa học
- Tác dụng vói axit mạnh hơn tạo ra muối mới
K2CO3 + 2CH3COOH → 2CH3COOK + CO2 + H2O
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
- Phản ứng với dung dịch kiềm tạo nên muối
K2CO3 + NaOH → Na2CO3 + KOH
- Tác dụng với dung dich muối để tạo ra muối mới bền vững hơn
K2CO3 + NaCl → KCl + Na2CO3
- Dễ bị phân hủy ở nhiệt độ cao để giải phóng khí cacbonic
K2CO3 → K2O + CO2
5. Cách thực hiện phản ứng
- Nhỏ H2SO4 vào ống nghiệm chứa K2CO3.
6. Bạn có biết
- K2CO3 phản ứng với các axit như HBr, HCl… đều giải phóng khí.
7. Bài tập liên quan
Ví dụ 1: Nhỏ H2SO4 vào ống nghiệm chứa K2CO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Hướng dẫn giải
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
CO2: khí không màu,
Đáp án A.
Ví dụ 2: Thể tích khí ở dktc thoát ra khi cho 13,8g K2CO3 phản ứng hoàn toàn với lượng dư H2SO4 là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3: Cho 1,38g K2CO3 phản ứng hoàn toàn với lượng H2SO4, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 2,38 gam.
B, 1,74 gam.
C. 0,475 gam.
D. 1,49 gam.
Hướng dẫn giải
Khối lượng muối = 0,01.174 = 1,74gam.
Đáp án B.
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
K2CO3 + 2HNO3 → 2KNO3 + CO2 + H2O
K2CO3 + Ba(OH)2 → 2KOH + BaCO3(↓)
K2CO3 + Ca(OH)2 → 2KOH + CaCO3(↓)
K2CO3 + CaCl2 → 2KCl + CaCO3(↓)
K2CO3 + BaCl2 → 2KCl + BaCO3(↓)