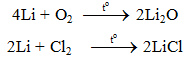Chúng tôi xin giới thiệu phương trình 2Li + 2CH3 COOH → 2CH3COOLi + H2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình hóa học của Li. Mời các bạn đón xem:
Phương trình 2Li + 2CH3 COOH → 2CH3COOLi + H2
1. Phương trình phản ứng hóa học:
2Li + 2CH3COOH → 2CH3COOLi + H2
2. Hiện tượng nhận biết phản ứng
Li tan dần trong và có khí thoát ra.
3. Điều kiện phản ứng
- Không cần điều kiện.
4. Tính chất hóa học
- Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
a. Tác dụng với phi kim
b. Tác dụng với axit
- Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
c. Tác dụng với nước
- Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
d. Tác dụng với hidro
- Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
5. Cách thực hiện phản ứng
- Cho liti tác dụng với axit axetic.
6. Bạn có biết
Li tham gia phản ứng cả axit vô cơ và axit hữu cơ.
7. Bài tập liên quan
Ví dụ 1: Cho Li dư tác dụng với a gam dung dịch CH3COOH CH3 COOH. thúc phản ứng, thấy khối lượng H2 sinh ra là 11a/240 . Tính nồng độ C% của dung dich axit
A. 10%
B. 25%
C. 4,58%
D. 36%
Đáp án: B
Hướng dẫn giải:
2CH3 COOH + 2NaOH → 2CH3 COONa + H2
2H2O + 2Na → 2NaOH + H2
Chọn a=240 gam
nH2=11/2 = 5,5 mol ; nCH3 COOH = 240.C/60 = 0,04C mol
nH2O = (240–2,4C)/18 mol
⇒ nCH3 COOH + nH2O = 2nH2
⇒ 0,04C + (240–2,4C)/18 = 2.5,5 ⇒ C=25
Ví dụ 2: Cho Li tác dụng với 100 gam dung dịch CH3 COOH. Kết thúc phản ứng thấy khối lượng H2 sinh ra là 0,1g . Vậy C% dung dịch muối thu được là:
A. 8,11%
B. 6,62%
C. 0,952 %
D. 0,82%
Đáp án: B
Hướng dẫn giải:
Phương trình hóa học: 2Li + 2CH3 COOH → 2CH3COOLi + H2
nLi = 2nH2 = 0,05.2 = 0,1 mol ⇒ mLi = 0,1.7 = 0,7 g
nCH3 COOLi = 2nH2 = 0,1 mol ⇒ mCH3 COOLi = 0,1.66 = 6,6 g
mdd = 0,7 + 100 – 1 = 99,7 g ⇒ C% = 6,6/99,7 = 6,62%
Ví dụ 3:Cho 0,7 g Li tác dụng với 100 ml dung dịch CH3 COOH 1M. Dung dịch sau phản ứng nhỏ vài giọt phenolphtalein. Dung dịch sẽ thu được sẽ thay đổi như thế nào?
A. Từ trắng sang không màu
B. Không màu sang màu hồng
C. Màu hồng sang không màu
D. Màu đỏ sang màu trắng
Đáp án: B
Hướng dẫn giải:
2Li + 2CH3COOH → 2CH3COOK + H2
nK = nCH3 COOH ⇒ sau phản ứng chỉ có muối CH3COOK
CH3COOK là muối tạo bởi bazo mạnh và axit yếu nên có môi trường bazo
⇒ phenophtalein chuyển sang màu hồng.
8. Một số phương trình phản ứng hóa học khác của Li: