Chúng tôi xin giới thiệu phương trình Al2O3 + NaOH → NaAlO2 + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình Al2O3 + NaOH → NaAlO2 + H2O
1. Phương trình phản ứng hóa học
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2. Hiện tượng nhận biết phản ứng.
- Nhôm oxit có màu trắng tan dần trong dịch
3. Điều kiện phản ứng
- Nhiệt độ: Từ 900oC - 1100oC
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của Al2O3 (Nhôm oxit)
Al2O3 là oxit lưỡng tính tác dụng được với bazo.
b. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh tác dụng được với Al2O3.
5. Tính chất hóa học
5.1. Tính chất hóa học của Al2O3
Al2O3 là oxit lưỡng tính
- Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
Al2O3 tác dụng với C
Al2O3 + 9C Al4C3 + 6CO
Tính bền:
Tính bền cũng là một trong những tính chất hóa học của nhôm oxit khá quan trọng. Lí do là vì Ion Al3+ có điện tích lớn(3+) và bán kính nhỏ(0.048nm), bằng 1/2 bán kính ion Na+ nên lực hút giữa ion Al3+ và ion O2– rất mạnh, tạo ra liên kết rất bền vững.
Vì thế Al2O3có nhiệt độ nóng chảy rất cao(2050oC) và rất khó bị khử thành kim loại Al.
Khử Al2O3 bằng C không cho Al mà thu được Al4C3
Al2O3 không tác dụng với H2, CO ở bất kì nhiệt độ nào.
5.2. Tính chất hóa học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
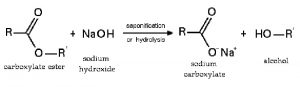
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
6. Cách thực hiện phản ứng
- Cho Al2O3 tác dụng với dung dịch bazo NaOH
7. Bạn có biết
- Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Al2O3 (Nhôm oxit) ra H2O (nước)
8. Bài tập liên quan
Câu 1. Dãy oxit nào sau đây có tính lưỡng tính
A. Cr2O3, Al2O3, Fe2O3, ZnO
B. CuO, ZnO, Al2O3, Fe2O3
C. ZnO, Cr2O3, Al2O3, PbO
D. Al2O3, K2O, SnO2, Al2O3
Lời giải:
Dãy oxit có tính lưỡng tính: ZnO, Cr2O3, Al2O3, PbO
Phương trình phản ứng minh họa
ZnO + 2HCl → ZnCl2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
Cr2O3+ 6HCl → 3H2O + 2CrCl3
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
PbO + 2HCl → PbCl2 + H2O
PbO + 2NaOH + H2O → Na2(Pb(OH)4)
Câu 2. Dung dịch chất nào sau đây không phản ứng với Al2O3?
A. H2SO4.
B. HCl.
C. NaOH.
D. Fe(NO3)3.
Lời giải:
Al2O3 là oxit lưỡng tính do đó có khả năng tác dụng với dung dịch axit và dung dịch bazo
Loại A vì H2SO4 tác dụng với Al2O3
Al2O3+ 3H2SO4→ Al2(SO4)3 + 3H2O
Loại B vì HCl tác dụng với Al2O3
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Loại C vì NaOH tác dụng với Al2O3
Al2O3 + 2NaOH → 2NaAlO2 + H2O
D đúng vì Fe(NO3)3 không tác dụng với Al2O3
Câu 3. Dãy các oxit nào sau đây đều bị khử bởi khí CO ở nhiệt độ cao?
A. Fe2O3, CuO, CaO
B. CuO, Na2O, MgO
C. CuO, Al2O3, Cr2O3
D. CuO, PbO, Fe2O3
Lời giải:
Phương pháp nhiệt luyện: dùng điều chế các kim loại có độ hoạt động trung bình như Zn, Fe, Sn, Pb,… bằng cách sử dụng các chất khử như C, CO, H2 hoặc các kim loại hoạt động như Al để khử ion kim loại trong hợp chất ở nhiệt độ cao.
→ Dãy các oxit CuO, PbO, Fe2O3 đều bị khử bởi khí CO ở nhiệt độ cao
CuO + CO → Cu + CO2
PbO2 + CO → PbO + CO2
Fe2O3 + 3CO → 2Fe + 3CO2
Câu 4. Hiện tượng nào sau đây là đúng.
A. Nhỏ từ từ dung dịch KOH vào dung dịch Al2(SO4)3 đến dư, lượng vừa xuất hiện, lắc tan, sau một thời gian lại xuất hiện nhiều dần.
B. Nhỏ từ từ dd HCl vào dd NaAlO2 cho đến dư, lượng xuất hiện nhiều dần, sau đó tan từ từ và mất hẳn.
C. Sục luồng khí CO2 từ từ vào dung dịch NaAlO2, xuất hiện, sau đó tan dần do khí CO2 có dư.
D. Cho một luồng khí CO2 từ từ vào nước vôi trong, xuất hiện nhiều dần và không tan trở lại ngay cả khi CO2
Lời giải:
Nhỏ từ từ dung dịch HCl vào dung dịch NaAlO2 cho đến dư, lượng xuất hiện nhiều dần, sau đó tan từ từ và mất hẳn.
Ban đầu:
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl.
Sau đó, Al(OH)3 ↓ + 3HCl → AlCl3 + 3H2O
Câu 5. Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Lời giải:
Nhóm các dung dịch có pH > 7 là những dung dịch có môi trường bazo
Loại vì A có HCl có môi trường axit => pH > 7
Loại vì B có H2SO4, HNO3 có môi trường axit => pH > 7
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Câu 6. Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím
B. HCl
C. NaCl
D. H2SO4
Lời giải:
Để phân biệt NaOH và Ba(OH)2 ta dùng dung dịch H2SO4
NaOH không có hiện tượng gì còn Ba(OH)2 tạo kết tủa màu trắng
Ba(OH)2 + H2SO4→ BaSO4 + 2H2O
Câu 7. Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
A. Ca(OH)2, Na2CO3
B. Ca(OH)2, NaCl
C. Ca(OH)2, NaNO3
D. NaOH, KNO3
Lời giải:
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
Ca(OH)2, Na2CO3 vì Ca(OH)2 và Na2CO3 tác dụng với nhau
Ca(OH)2 + Na2CO3→ CaCO3 ↓ + 2NaOH
B loại vì Ca(OH)2 và NaCl không tác dụng với nhau
C Loại vì Ca(OH)2 và NaNO3 không tác dụng với nhau
D loại vì NaOH, KNO3 không tác dụng với nhau
Câu 8. Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO4 1M thì dung dịch tạo thành sau phản ứng sẽ:
A. Làm quỳ tím chuyển đỏ
B. Làm quỳ tím chuyển xanh
C. Làm dung dịch phenolphtalein không màu chuyển đỏ.
D. Không làm thay đổi màu quỳ tím.
Lời giải:
nNaOH= 0,2.1=0,2 mol;
nH2SO4 = 0,1.1 = 0,1 mol
Phương trình hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Xét tỉ lệ: = = = 0,1 => NaOH và H2SO4 phản ứng vừa đủ với nhau
=> dung dịch thu được có môi trường trung tính => không làm thay đổi màu quỳ tím.
Câu 9. Oxit nhôm không có tính chất hoặc ứng dụng nào sau đây?
A. Dễ tan trong nước
B. Có nhiệt độ nóng chảy cao
C. Là oxit lưỡng tính
D. Dùng để điều chế nhôm
Lời giải:
Câu 10. Nguyên liệu chính để sản xuất nhôm là:
A. Quặng pirit
B. Quặng đôlômit
C. Quặng manhetit
D. Quặng boxit
Lời giải:
Nguyên liệu chính để sản xuất nhôm là Quặng boxit
9. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:

