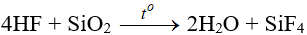Chúng tôi xin giới thiệu phương trình Mn + F2 → MnF2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Mangan. Mời các bạn đón xem:
Phương trình Mn + F2 → MnF2
1. Phương trình phản ứng hóa học:
Mn + F2 → MnF2
2. Hiện tượng nhận biết phản ứng
Xuất hiện chất rắn kết tinh màu hồng nhạt
3. Điều kiện phản ứng
Nhiệt độ
4. Tính chất hoá học
a. Tính chất hoá học của Mangan
- Trạng thái ôxi hóa phổ biến của nó là +2, +3, +4, +6 và +7. Trạng thái ôxy hóa ổn định nhất là mangan +2.
- Mangan có tính khử khá mạnh
Tác dụng với phi kim
- Tác dụng trực tiếp được với nhiều phi kim.
Mn (bột) + O2→ MnO2. (tự bốc cháy)
Mn + Cl2 → MnCl2.
Tác dụng với axit
- Tác dụng với HCl và H2SO4 loãng:
Mn (bột) + 2HCl (loãng) → MnCl2 + H2
- Tác dụng với HNO3 và H2SO4 đặc:
Mn + 2H2SO4 (đặc) → MnSO4 + SO2 + 2H2O.
3Mn + 8HNO3 (loãng, nóng) → 3Mn(NO3)2 + 2NO + 4H2O.
Tác dụng với nước
Mn (bột) + 2H2O (hơi) → Mn(OH)2 + H2
b. Tính chất hoá học của F2
Tác dụng với kim loại và phi kim
Ca + F2 → CaF2
2Ag + F2 → 2AgF
3F2 + 2Au → 2AuCl3
3F2 + S → SF6
Tác dụng với hidro:
- Phản ứng xảy ra mạnh hơn các halogen khác, hỗn hợp H2, F2 nổ mạnh trong bóng tối.
H2 + F2 → 2HF
- Khí HF tan vào nước tạo dung dịch HF. Dung dịch HF là axit yếu, đặc biệt là hòa tan được SiO2.
(sự ăn mòn thủy tinh được ứng dụng trong kĩ thuật khắc trên kính như vẽ tranh khắc chữ)
Tác dụng với nước
Khí flo qua nước sẽ làm bốc cháy nước (do giải phóng O2).
2F2 + 2H2O → 4HF + O2
Phản ứng này giải thích vì sao F2 không đẩy Cl2, Br2, I2 ra khỏi dung dịch muối hoặc axit trong khi flo có tính oxi hóa mạnh hơn.
5. Cách thực hiện phản ứng
Cho mangan tác dụng với flo
6. Bạn có biết
Mn là kim loại có tính khử nên dễ dàng tham gia phản ứng với các chất có tính oxi hóa như F2; Cl2 …
7. Bài tập liên quan
Ví dụ 1: . Khi cho 11 g một kim loại R hoá trị II tác dụng với F2 thu được 18,6 g muối. Tìm kim loại R?
A. Cu
B. Mn
C. Zn
D. Fe
Hướng dẫn giải:
Đáp án B
Phương trình hóa học : R + F2 → RF2
Ta có : nR = 11/R mol ; nRF2 = 18,6/(R+19.2) mol
Theo phương trình : nR = nRFa ⇒ 11/R = 18,6/(R+38) ⇒ R = 418/7,6 = 55
⇒ kim loại R là Mn
Ví dụ 2: Khi cho 11 g một kim loại Mn tác dụng với F2 thu được m g muối. Gía trị của m ?
A. 9,3g
B.13,95g
C. 18,6g
D. 23,25g
Hướng dẫn giải:
Đáp án C
Phương trình hóa học : Mn + F2 → MnF2
Ta có : nMn = 11/55 = 0,2 mol ; theo phương trình : nMnF2 = nMn = 0,2 mol
⇒ mMnF2 = 0,2.93 = 18,6 g
Ví dụ 3: Mangan tác dụng với chất nào sau đây ?
A. Na2SO4, O2, KNO3
B. NaOH, S, N2
C. KOH, HCl, Cl2
D. N2, HCl, S
Hướng dẫn giải:
Đáp án D
Mn + F2 → MnF2
Mn + S →MnS
Mn + 2HCl → MnCl2 + H2
8. Một số phương trình phản ứng hoá học khác của Mangan (Mn) và hợp chất:
Mn + H2SO4(loãng) → MnSO4 + H2
Mn(bột) + 2H2O → Mn(OH)2 + H2 ↑
Mn + 2H2SO4(đặc) → MnSO4 + 2H2O + SO2