Chúng tôi xin giới thiệu phương trình 2Al2S3 + 3SiO2 → 2Al2O3 + 3SiS2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình 2Al2S3 + 3SiO2 → 2Al2O3 + 3SiS2
1. Phương trình phản ứng hóa học:
2Al2S3 + 3SiO2 → 2Al2O3 + 3SiS2
2. Hiện tượng nhận biết phản ứng
- Phản ứng tạo thành nhôm oxit và silic đisunfua
3. Điều kiện phản ứng
- Nhiệt độ: 1200 - 1300oC
4. Tính chất hoá học
a. Tính chất hoá học của Al2S3
- Tác dụng với nước
Al2S3 + H2O → Al(OH)3 + H2S
- Tác dụng với axit
Al2S3 + HCl → AlCl3 + H2S
- Tác dụng với dung dịch bazo
Al2S3 + NaOH → Al(OH)3 + Na2S
- Tác dụng với dung dịch muối
Al2S3 + Cu(NO3)2 → Al(NO3)3 + CuS
b. Tính chất hoá học của SiO2
- SiO2 là oxit axit.
- Silic đioxit không phản ứng với nước.
- Ở nhiệt độ cao, tác dụng với kiềm và oxit bazơ tạo thành muối silicat. Ví dụ:
SiO2 + 2NaOH 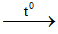
SiO2 + CaO 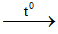
5. Cách thực hiện phản ứng
- Cho Al2S3 tác dụng với SiO2
6. Bài tập liên quan
Ví dụ 1: Dãy gồm các oxit đều bị Al khử ở nhiệt độ cao là:
A. PbO, K2O, SnO.
B. FeO, MgO, CuO.
C. Fe3O4, SnO, BaO.
D. FeO, CuO, Cr2O3.
Đáp án: D
Hướng dẫn giải
Phản ứng nhiệt nhôm là để khử các oxit kim loại đứng sau Al trong dãy điện hóa. Vậy các oxit thỏa mãn điều kiện trên là: PbO, SnO, FeO, CuO, Fe3O4, Cr2O3.
Ví dụ 2: Cho các quặng sau: pirit, thạch cao, mica, apatit, criolit, boxit, dolomit. Số quặng chứa nhôm là:
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: B
Hướng dẫn giải
Cryolit: Na3AlF6 hay AlF3.3NaF
Boxit: Al2O3.nH2O
Mica: K2O.Al2O3.6SiO2.2H2O
Ví dụ 3: Cho sơ đồ phản ứng: Al → X → Al2O3 → Al
X có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Đáp án: C
7. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
AlF3 + 3NH4OH → Al(OH)3↓ + 3NH4F

