Chúng tôi xin giới thiệu phương trình Al2O3 + 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 3H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình Al2O3 + 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 3H2O
1. Phương trình phản ứng hóa học:
Al2O3 + 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 3H2O
2. Hiện tượng nhận biết phản ứng
- Nhôm oxit tan dần trong dung dịch natri hidrosunfat
3. Điều kiện phản ứng
- Nhiệt độ phòng
4. Tính chất hoá học
a. Tính chất hoá học của Al2O3
- Al2O3 là oxit lưỡng tính.
+ Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
- Al2O3 tác dụng với C
Al2O3 + 9C 
b. Tính chất hoá học của NaHSO4
– NaHSO4 làm đổi màu quỳ tím sang đỏ
– NaHSO4 tác dụng với bazơ
NaHSO4 + NaOH → Na2SO4 + H2O
NaHSO4 + Ba(OH)2 → BaSO4 + Na2SO4 + H2O
– Tác dụng với kim loại
NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
NaHSO4 + Na → Na2SO4 + H2
5. Cách thực hiện phản ứng
- Cho Al2O3 tác dụng với NaHSO4
6. Bài tập liên quan
Ví dụ 1: Trong những chất sau, chất nào không có tính lưỡng tính?
A. Al(OH)3
B. Al2O3
C. ZnSO4
D. NaHCO3.
Đáp án: C
Hướng dẫn giải
Trong những chất trên, chất không có tính lưỡng tính là ZnSO4.
Ví dụ 2: Cho Al tác dụng với lần lượt các dung dịch axit sau: HCl, HNO3 loãng; H2SO4 đặc, nóng; HNO3 đặc, nguội; H2SO4 loãng. Số dung dịch có thể hòa tan được Al là:
A. 3
B. 2
C. 5
D. 4
Đáp án: D
Hướng dẫn giải
2Al + 6HCl(l) → 2AlCl3 + 3H2;
Al + 4HNO3 loãng → Al(NO3)3 + NO + 2H2O
2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2 + 3H2O
Al + 3H2SO4(l) → Al2(SO4)3 + 3H2.
Ví dụ 3: Cho bột Al vào dung dịch KOH dư, ta thấy hiện tượng?
A. Sủi bọt khí, bột Al không tan hết và thu được dung dịch không màu.
B. Sủi bọt khí, Al không tan hết và dung dịch màu xanh lam.
C. Sủi bọt khí, Al tan dần đến hết và thu được dung dịch không màu.
D. Sủi bọt khí, bột Al tan dần đến hết và thu được dung dịch màu xanh lam.
Đáp án: C
Hướng dẫn giải
2Al + 2H2O + 2KOH → 3H2 + 2KAlO2
7. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al2O3 + 3C + 3Cl2 → 2AlCl3 + 3CO↑
2Al2O3 + 3C + N2 → 2AlN + 3CO↑
Al2O3 + 6NaOH + 12HF → 9H2O + 2Na3AlF6

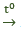 Al2O3 + 3H2O
Al2O3 + 3H2O