Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 18: Tính chất của kim loại. Dãy điện hóa kim loại chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất của kim loại. Dãy điện hóa kim loại lớp 12.
Bài giảng Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa kim loại
Giải bài tập Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa kim loại.
Câu hỏi và bài tập (trang 88,89 SGK Hóa Học 12)
Bài 1 trang 88 SGK Hóa Học 12: Giải thích vì sao kim loại đều có tính vật lí chung là dẫn điện, dẫn nhiệt, dẻo và có ánh kim.
Lời giải:
Kim loại đều có tính chất vật lí chung là dẫn điện, dẫn nhiệt, dẻo và có ánh kim là do sự có mặt của các electron tự do trong mạng tinh thể kim loại.
Bài 2 trang 88 SGK Hóa Học 12: Tính chất hoá học cơ bản của kim loại là gì và vì sao kim loại lại có tính chất đó?
Lời giải: Tính chất hóa học chung của kim loại là tính khử
M – ne → Mn+
Bởi vì:
Nguyên tử kim loại có số electron hóa trị ít 1,2,3 electron.
Trong cùng một chu kỳ bán kính nguyên tử kim loại lớn, điện tích hạt nhân nhỏ.
Năng lượng ion hóa nguyên tử kim loại nhỏ.
Vì vậy lực liên kết giữa hạt nhân với các electron hóa trị của kim loại là yếu nên chúng dễ tách ra khỏi nguyên tử. Kim loại thể hiện tính khử.
Bài 3 trang 89 SGK Hóa Học 12: Thuỷ ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thuỷ ngân bị vỡ thì dùng chất nào trong các chất sau để khử độc thuỷ ngân.
A. Bột sắt B. Bột lưu huỳnh
C. Bột than D. Nước
Lời giải:
Lưu huỳnh tác dụng ngay với Hg ở nhiệt độ phòng tạo muối HgS↓
Hg (lỏng, độc) + S (rắn) → HgS↓(rắn, không độc)
Đáp án B
Bài 4 trang 89 SGK Hóa Học 12: Dung dịch FeSO4 có lẫn tạp chất CuSO4. Hãy giới thiệu một phương pháp hoá học đơn giản để có thể loại được tạp chất.
Lời giải:
Nhúng một thanh sắt vào dung dịch và để một thời gian cho phản ứng xảy ra hoàn toàn.
CuSO4 + Fe → FeSO4 + Cu
Toàn bộ Cu thoát ra bám trên bề mặt thanh sắt, lấy thanh sắt ra ta còn lại dung dịch chỉ có FeSO4
Bài 5 trang 89 SGK Hóa Học 12: Nhúng một lá sắt nhỏ vào dung dịch chứa một trong những chất sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3, H2SO4(đặc nóng), NH4NO3. Số trường hợp phản ứng tạo muối Fe(II) là
A. 3. B. 4. C. 5. D. 6.
Lời giải:
Fe tác dụng với các chất tạo muối Fe (II) là:FeCl3, CuSO4, Pb(NO3)2,HCl.
Fe + 2FeCl3 → 3FeCl2
Fe + CuSO4 → FeSO4 + Cu↓
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb↓
Fe + 2HCl → FeCl2 + H2↑
=> Có tất cả 4 trường hợp tạo muối Fe(II)
Đáp án B
Bài 6 trang 89 SGK Hóa Học 12: Cho 5,5 gam hỗn hợp bột Al và Fe (trong đó số mol Al gấp đôi Fe) vào 300 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam B. 35,20 gam
C. 39,35 gam D. 35,39 gam
Phương pháp giải:
Gọi nFe = x (mol) => nAl = 2nFe = 2x (mol)
Bảo toàn khối lượng => 56x + 2x. 27 = 5,5
=> x = ?
Viết PTHH có xảy ra theo thứ tự:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓ (1)
Fe + 3AgNO3 → Fe(NO3)2+ 3Ag↓ (2)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ (3)
Tính toán theo PTHH (1), (2), (3)
m rắn = mAg↓ + mKL dư
Gọi nFe = x (mol) => nAl = 2nFe = 2x (mol)
Bảo toàn khối lượng => 56x + 2x. 27 = 5,5
=> x = 0,05 (mol)
=> nFe = 0,05 (mol) => nAl = 0,1 (mol)
nAgNO3 = 0,3.1 = 0,3 (mol)
Viết PTHH có xảy ra theo thứ tự:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓ (1)
Fe + 2AgNO3 → Fe(NO3)2+ 2Ag↓ (2)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ (3)
nAl = 0,1 (mol); nAgNO3 = 0,3 (mol) => chỉ xảy ra phản ứng (1). Không xảy ra phản ứng (2) và (3)
=> m rắn = mAg↓ + mFe dư
= 0,1.3.108 + 0,05.56
= 35,2 (g)
Đáp án B
Bài 7 trang 89 SGK Hóa Học 12: Hãy sắp xếp theo chiều giảm tính khử và chiều tăng tính oxi hoá của các nguyên tử và ion trong hai trường hợp sau đây:
a) Fe, Fe2+, Fe3+, Zn, Zn2+, Ni, Ni2+, H, H+, Hg, Hg2+, Ag, Ag+.
b) Cl, Cl-, Br, Br-, F, F-, I, I-.
Phương pháp giải:
Ghi nhớ.
+ Kim loại có tính khử càng mạnh thì cation tương ứng của nó có tính oxi hóa càng yếu.
+ Phi kim có tính oxi hóa càng mạnh thì anion tương ứng của nó có tính khử càng yếu.
Lời giải:
a) Tính khử giảm dần theo thứ tự: Zn > Fe > Ni > H > Hg > Ag
Tính oxi hóa tăng dần theo thứ tự: Zn2+ < Fe2+ < Ni2+ < H+ < Hg2+ < Fe3+ < Ag+
b) Tính khử giảm dần theo thứ tự: I– > Br– > Cl– > F–
Tính oxi hóa tăng dần theo thứ tự: I < Br < Cl < F
Bài 8 trang 89 SGK Hóa Học 12: Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi
A. Cấu tạo mạng tinh thể của kim loại
B. Khối lượng riêng của kim loại
C. Tính chất của kim loại
D. Các electron tự do trong tinh thể kim loại
Lời giải:
I. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
1. Tính chất vật lí chung
a) Tính dẻo
=> Kim loại có tính dẻo nhất là Au
b) Tính dẫn điện
=> Khả năng dẫn điện của một số kim loại Ag > Cu > Au > Al > Fe
c) Tính dẫn nhiệt
d) Tính ánh kim
=> Tính chất vật lí chung của kim loại như nói ở trên gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
2. Tính chất vật lí riêng
Một số tính chất vật lý riêng của kim loại:
a) Tính cứng
=> Kim loại mềm nhất là Cs, kim loại cứng nhất là Cr
b) Nhiệt độ nóng chảy
=> Kim loại dễ nóng chảy nhất là Hg (-39 độ C), khó nóng chảy nhất là W
c) Khối lượng riêng
- Kim loại có khối lượng riêng D < 5 gam/cm3 là kim loại nhẹ (Na, Li, Mg, Al,…)
- Kim loại có khối lượng riêng D > 5 gam/cm3 là kim loại nặng.( Cr, Fe, Zn, Pb, Ag, Hg,…)
II. TÍNH CHẤT HÓA HỌC CHUNG CỦA KIM LOẠI
Tính chất điển hình của kim loại là tính khử: M → Mn+ + ne
1. Tác dụng với phi kim
a) Tác dụng với clo
Hầu hết các kim loại đều có thể khử trực tiếp clo → muối clorua
b) Tác dụng với oxi
c) Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh từ xuống . Phản ứng cần đun nóng (trừ Hg). Ví dụ:
2. Tác dụng với dung dịch axit
a) Với dung dịch HCl, H2SO4 loãng
Kim loại đứng trước H trong dãy hoạt động hóa học có thể tác dụng được với axit để sinh ra khí H2 bay lên.
b) Với dung dịch HNO3, H2SO4 đặc
KL + (H2SO4 đ, HNO3) → muối + sản phẩm khử (SO2, NO, NO2, H2S ….) + H2O
Chú ý : HNO3, H2SO4 đặc, nguội làm thụ động hoá Al, Fe, Cr, ...
KL sẽ lên số OXH cao nhất khi tác dụng với dung dịch HNO3, H2SO4 đặc.
3. Tác dụng với nước
4. Tác dụng với dung dịch muối
- Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
- Với các kim loại không tan trong nước, kim loại hoạt động đẩy được kim loại kém hoạt động ra khỏi dung dịch muối của chúng theo quy tắc α.
5. Tác dụng với dung dịch kiềm
Các kim loại mà hiđroxit của chúng có tính lưỡng tính như Al, Zn, Be, Sn, Pb... tác dụng được với dung dịch kiềm (đặc).
2Al + 6H2O + 2NaOH → 2Na[Al(OH)4] + 3H2
6. Tác dụng với oxit kim loại
Các kim loại mạnh khử được các oxit kim loại yếu hơn ở nhiệt độ cao thành kim loại
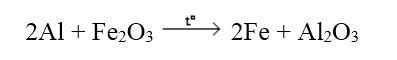
III. DÃY ĐIỆN HÓA CỦA KIM LOẠI
- Các kim loại trong dãy điện hoá được sắp xếp theo chiều tính khử của kim loại giảm dần và tính oxi hoá của ion kim loại tăng dần.
- Dãy điện hoá cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hoá - khử: chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
Một số lưu ý cần nhớ:
Để có thể dễ dàng giải được loại bài tập này, các em cần nắm rõ được các định luật bảo toàn electron, định luật bảo toàn khối lượng, … để áp dụng
Dạng 1: Kim loại tác dụng với phi kim
* Một số ví dụ điển hình:
Ví dụ 1: Đốt cháy hoàn toàn 3 gam hỗn hợp T gồm Al và Cu cần vừa đủ 1,456 lít hỗn hợp khí gồm O2 và Cl2 thu được 6,64 gam chất rắn. Phần trăm khối lượng của Al trong T là?
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn khối lượng
=> m O2 + m Cl2 = m Chất rắn – m KL = 6,64 – 3 = 3,64 gam
n O2 + n Cl2 = 1,456 : 22,4 = 0,065 (mol)
Gọi số mol O2, Cl2 lần lượt là a, b
=> Ta có hệ phương trình:
a + b = 0,065
32a + 71b = 3,64
=> a = 0,025 ; b = 0,04
Gọi số mol Al, Cu lần lượt là x, y
Áp dụng định luật bảo toàn electron:
=> Tổng lượng e nhường của KL bằng tổng lượng e nhận của phi kim (O2, Cl2)
=> 3x + 2y = 4. n O2 + 2. n Cl2
=> 3x + 2y = 4 . 0,025 + 2 . 0,04 = 0,18 (I)
Khối lượng của 2 kim loại bằng 3 gam
=> 27x + 64y = 3 (II)
Từ (I) và (II) => x = 0,04 ; y = 0,03
% Al = (0,04 . 27) : 3 . 100% = 36%
Ví dụ 2: Chia hỗn hợp Al, Cu thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần 1 cần vừa đủ 1,344 lít O2. Cho phần 2 tác dụng với tối đa V lít khí Cl2 (dktc) thì giá trị cuả V là?
Hướng dẫn giải chi tiết:
n O2 = 1,344 : 22,4 = 0,06 (mol)
Phần 1 phản ứng vừa đủ với 0,06 mol O2
=> Ta có quá trình nhận e của oxi như sau:
O2 + 4e → 2O2-
0,06 → 0,24
=> Tổng số e nhận trong phản ứng này là 0,24 mol
Cl2 + 2e → Cl-
0,12 0,24
=> V Cl2 = 0,12 . 22,4 = 2,688 (lít)
Dạng 2: Kim loại tác dụng với axit
Ví dụ 1: Cho 8,85 g hỗn hợp Mg, Cu và Zn vào lượng dư dung dịch HCl thu được 3,36 lít H2 (đktc). Phần chất rắn không phản ứng với axit được rửa sạch rồi đốt cháy trong oxi tạo ta 4 g chất bột màu đen. Phần trăm khối lượng của Mg, Cu, Zn lần lượt là
Hướng dẫn giải chi tiết:
Đặt nMg = x và nZn = y mol
Ta có hệ phương trình:
Vậy:
Ví dụ 2: Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
Hướng dẫn giải chi tiết:
Sơ đồ: KL + H2SO4 → Muối + H2
Bảo toàn H → nH2SO4 = nH2 = 1,344/22,4 = 0,06 mol
Bảo toàn khối lượng
→ mmuối = mKL + mH2SO4 - mH2 = 1,9 + 0,06.98 - 0,06.2 = 7,66 gam
Ví dụ 3: Cho 2,91 gam hỗn hợp X gồm Mg, Cu, Al tan hết trong dung dịch HNO3 loãng, dư thu dược 1,12 lít khí NO ở đktc ( không còn sản phẩm khử khác) và dung dịch Y. Cho Y tác dụng với dung dịch NaOH thì thu được lượng kết tủa lớn nhất là m gam. Giá trị của m là
Hướng dẫn giải chi tiết:
Bảo toàn e có 2nMg + 3nAl + 2nCu = 3nNO = 0,15 mol
Khối lượng kết tủa thu được lớn nhất khi kết tủa hoàn toàn Mg(OH)2, Al(OH)3 và Cu(OH)2
=> nOH- = 2nMg + 3nAl + 2nCu = 0,15 mol
=> mkết tủa = mKL + mOH = 2,91 + 0,15.17 = 5,46 gam
Ví dụ 4: Cho 6,72 gam Fe phản ứng với 125 ml dung dịch HNO3 3,2M thu được dung dịch X và khí NO (sản phẩm khử duy nhất của N+5). Biết các phản ứng xảy ra hoàn toàn, khối lượng muối trong dung dịch X là
Hướng dẫn giải chi tiết:
nFe = 0,12 mol; nHNO3 = 0,125.3,2 = 0,4 mol
Giả sử tạo thành 2 muối Fe(NO3)2 x mol và Fe(NO3)3 y mol
Bảo toàn nguyên tố Fe:
nFe = nFe(NO3)2 + nFe(NO3)3 => x + y = 0,12 (1)
Ta có: nHNO3 = 4nNO => nNO = 0,4 / 4 = 0,1 mol
Bảo toàn e: 2nFe(NO3)2 + 3nFe(NO3)3 = 3nNO
=> 2x + 3y = 0,1.3 (2)
Từ (1) và (2) => x = 0,06 và y = 0,06 mol
=> mmuối = mFe(NO3)2 + mFe(NO3)3 = 25,32 gam
Dạng 3: Kim loại tác dụng với dung dịch muối
Ví dụ 1: Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
Hướng dẫn giải chi tiết:
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1
=> mtăng = 0,1.108 – 0,05.56 = 8 < 8,8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phầ
Fe + Cu2+ → Fe2+ + Cu
x → x → x
=> mtăng = 64x – 56x = 8x
=> tổng khối lượng tăng ở 2 phản ứng là:
mtăng = 8 + 8x = 8,8 => x = 0,1 mol
=> mkim loại bám vào = mAg + mCu = 17,2 gam
Ví dụ 2: Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 25,8 gam chất rắn. Giá trị của a là
Hướng dẫn giải chi tiết:
nAl2(SO4)3 = 0,1 mol; nCuSO4 = 0,3 mol => nAl3+ = 0,2 mol; nCu2+ = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 25,8 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 < 25,8 gam
=> cả Cu2+ và Al3+ phản ứng hết, Mg dư
=> chất rắn sau phản ứng gồm Cu (0,3 mol), Al (0,2 mol) và Mg
=> mMg dư = 25,8 – 24,6 = 1,2 gam
Bảo toàn e: 2nMg phản ứng = 3nAl + 2nCu
=> nMg phản ứng = (3.0,2 + 0,3.2) / 2 = 0,6 mol
=> m = 0,6.24 + 1,2 = 15,6
Dạng 4: Kim loại tác dụng với dung dịch kiềm
* Một số ví dụ điển hình:
Ví dụ 1: Cho 11,8 gam hỗn hợp X gồm Al và Cu vào dung dịch NaOH (loãng, dư). Khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít khí H2 (đktc). Khối lượng của Cu trong hỗn hợp X là
Hướng dẫn giải chi tiết:
Khi cho hỗn hợp X gồm Al và Cu vào dung dịch NaOH loãng dư thì chỉ có Al phản ứng.
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Ta có: nAl = 2/3.nH2 = 2/3.0,3 = 0,2 (mol)
→ mCu = mX - mAl = 11,8 - 0,2. 27 = 6,4 (g)
Ví dụ 2: Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 6,72 lít khí (đktc). Thể tích dung dịch NaOH tối thiểu cần dùng là
Hướng dẫn giải chi tiết:
nH2(đktc) = VH2/22,4 = 6,72/22,4 = 0,3 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,2 ← 0,3
Theo PTHH: nNaOH = 2/3 nH2 =2/3×0,3 =0,2 (mol)
→ VNaOH = nNaOH : CM = 0,2 : 1 = 0,2 (lít) = 200 (ml)
Dạng 1: Lý thuyết về tính chất của KL
* Một số ví dụ điển hình:
Ví dụ 1: Cho các câu phát biểu về vị trí và cấu tạo của kim loại như sau :
(I) : Hầu hết các kim loại chỉ có từ 1 đến 3 electron lớp ngoài cùng.
(II) : Tất cả các nguyên tố nhóm B đều là kim loại.
(III) : Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể.
(IV) : Liên kết kim loại là liên kết được hình thành do sức hút tĩnh điện giữa các ion dương kim loại và các electron tự do.
Những phát biểu nào đúng ?
A. Chỉ có I đúng
B. Chỉ có I, II đúng
C. Chỉ có IV sai.
D. Cả I, II, III, IV đều đúng.
Hướng dẫn giải chi tiết
Dựa vào tính chất của KL đã được học trong SGK, thì cả 4 phát biểu trên đều đúng.
Đáp án D.
Ví dụ 2: Kim loại có tính chất vật lí chung là dẫn điện, dẫn nhiệt, dẻo và có ánh kim. Nguyên nhân của những tính chất vật lí chung của kim loại là do trong tinh thể kim loại có
A. nhiều electron độc thân.
B. các ion dương chuyển động tự do.
C. các electron chuyển động tự do.
D. nhiều ion dương kim loại.
Hướng dẫn giải chi tiết
Nguyên nhân gây nên tính chất vật lý chung của kim loại là do các electron chuyển động tự do
Đáp án C.
Ví dụ 3: Phát biểu nào sau đây là phù hợp với tính chất hoá học chung của kim loại ?
A. Kim loại có tính khử, nó bị khử thành ion âm.
B. Kim loại có tính oxi hoá, nó bị oxi hoá thành ion dương.
C. Kim loại có tính khử, nó bị oxi hoá thành ion dương.
D. Kim loại có tính oxi hoá, nó bị khử thành ion âm.
Hướng dẫn giải chi tiết:
Tính chất hóa học chung của kim loại là tính khử, nó bị OXH thành ion dương
Đáp án C.
Ví dụ 4: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là :
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Hướng dẫn giải chi tiết:
Do lưu huỳnh có khả năng tác dụng với thủy ngân ngay ở nhiệt độ thường nên người ta hay sử dụng chất này để thu hồi thủy ngân:
Hg + S → HgS
Đáp án D
Dạng 2: Lý thuyết về dãy điện hóa KL và pin điện hóa
* Một số lưu ý cần nhớ:
- Dãy điện hóa của kim loại là một dãy các cặp OXH – Khử sắp xếp theo chiều tăng dần tính OXH của ion kim loại và giảm dần tính khử của nguyên tử kim loại.
Ví dụ:
2Ag+ + Cu → Cu2+ + 2Ag
Chất oxi hoá mạnh + Chất khử mạnh → Chất oxi hoá yếu + Chất khử yếu
- Cấu tạo pin điện hóa:
VD: Xét pin điện hóa Zn|Cu gồm có:
Cực anot (cực âm) xảy ra quá trình OXH:
Zn → Zn+2 +2e
Cực catot (cực dương) xảy ra quá trình khử:
Cu+2 + 2e → Cu
=> Ta có phương trình hóa học điễn ra trong pin điện hóa:
Zn + Cu2+ → Zn2+ + Cu
* Lưu ý: Trong pin điện hóa, kim loại mạnh hơn sẽ là cực âm, kim loại còn lại sẽ là cực dương.
* Một số ví dụ điển hình
Ví dụ 1: : Trong pin điện hoá Zn – Cu, phản ứng hoá học nào xảy ra ở điện cực âm ?
A. Cu → Cu2+ + 2e.
B. Cu2+ + 2e → Cu.
C. Zn2+ + 2e → Zn.
D. Zn → Zn2+ + 2e.
Hướng dẫn giải chi tiết:
Cực âm (anot) là nơi diễn ra quá trình OXH của kim loại có tính khử mạnh
=> phản ứng hóa học diễn ra ở cực âm trong pin là: Zn ® Zn2+ + 2e.
Đáp án D.
Ví dụ 2: Pin điện hoá được tạo thành từ các cặp oxi hoá khử sau đây : Fe2+/Fe và Pb2+/Pb ; Fe2+/Fe và Zn2+/Zn ; Fe2+/Fe và Sn2+/Sn ; Fe2+/Fe và Ni2+/Ni. Số trường hợp sắt đóng vai trò cực âm là :
A. 4.
B. 3.
C. 2.
D. 1.
Hướng dẫn giải chi tiết:
Cặp OXH/Khử mà Fe đóng vai trò cực âm là cặp mà Fe có tính khử mạnh hơn kim loại còn lại.
=> Các cặp phù hợp là: Fe2+/Fe và Pb2+/Pb; Fe2+/Fe và Sn2+/Sn ; Fe2+/Fe và Ni2+/Ni.
Đáp án B.
Ví dụ 3: Trong quá trình hoạt động của pin điện hoá Cu – Ag, nồng độ của các ion trong dung dịch biến đổi như thế nào ?
A. Nồng độ của ion Ag+ tăng dần và nồng độ của ion Cu2+ tăng dần.
B. Nồng độ của ion Ag+ giảm dần và nồng độ của ion Cu2+ giảm dần.
C. Nồng độ của ion Ag+ giảm dần và nồng độ của ion Cu2+ tăng dần.
D. Nồng độ của ion Ag+ tăng dần và nồng độ của ion Cu2+ giảm dần.
Hướng dẫn giải chi tiết:
Xét pin điện hóa Cu – Ag
Tại cực âm: Cu → Cu+2 + 2e
Tại cực dương: Ag+ + 1e → Ag
=> Phương trình hóa học diễn ra trong pin này là:
Cu + 2Ag+→ Cu2+ + 2Ag
=> Nồng độ của ion Ag+ giảm dần và nồng độ của ion Cu2+ tăng dần.
Đáp án C.
Ví dụ 4: Cho các phản ứng hóa học sau :
Fe + Cu2+ → Fe2+ + Cu
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Nhận xét nào sau đây sai ?
A. Tính khử của Fe mạnh hơn Cu.
B. Tính oxi hóa của Fe3+ mạnh hơn Cu2+.
C. Tính oxi hóa của Fe2+ yếu hơn Cu2+.
D. Tính khử của Cu yếu hơn Fe2+.
Hướng dẫn giải chi tiết:
Fe + Cu2+ → Fe2+ + Cu
=> Fe có tính khử mạnh hơn Cu => A đúng
=> Cu2+ có tính OXH mạnh hơn Fe2+ => C đúng
Cu + 2Fe3+ → Cu2+ + 2Fe2+
=> Cu có tính khử mạnh hơn Fe2+ => D sai
=> Fe3+ có tính OXH mạnh hơn Cu2+ => B đúng
Đáp án D.
Ví dụ 5 : Ngâm bột Fe vào các dung dịch muối riêng biệt Fe3+, Zn2+, Cu2+, Pb2+, Mg2+, Ag+. Số phản ứng xảy ra là :
A. 4.
B. 5.
C. 3.
D. 6.
Hướng dẫn giải chi tiết :
Theo dãy cặp OXH – Khử , Fe có thể phản ứng được với các ion : Fe3+, Cu2+, Pb2+, Ag+
Đáp án A

