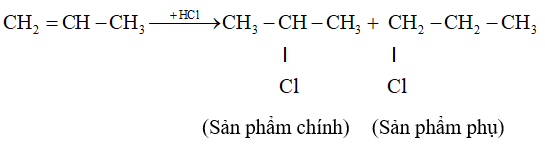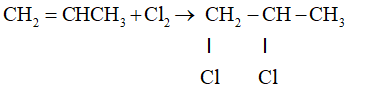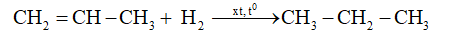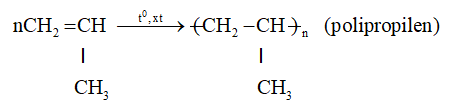Chúng tôi xin giới thiệu phương trình 3CH2=CH–CH3+ 4H2O + 2KMnO4 → 3OH-CH2–CH(OH)– CH3+ 2MnO2+ 2KOH gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình 3CH2=CH–CH3+ 4H2O + 2KMnO4 → 3OH-CH2–CH(OH)– CH3+ 2MnO2+ 2KOH
1. Phản ứng hóa học:
3CH2=CH–CH3 + 4H2O + 2KMnO4 
2. Điều kiện phản ứng
- Phản ứng xảy ra ngay ở điều kiện thường.
3. Cách thực hiện phản ứng
- Sục khí propilen vào dung dịch thuốc tím (KMnO4), thấy màu của dung dịch thuốc tím nhạt dần và có kết tủa màu nâu đen của MnO2.
4. Hiện tượng nhận biết phản ứng
- Màu của dung dịch thuốc tím nhạt dần và có kết tủa màu nâu đen của MnO2.
5. Tính chất hóa học
5.1. Tính chất hóa học của C3H6
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
Phản ứng cộng axit hoặc nước vào propen thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
- Cộng Brom
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
b. Phản ứng trùng hợp
- Propen trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Propen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C3H6 + O2 → 3CO2 + 3H2O
- Propen làm mất màu dung dịch KMnO4:
3C3H6 + 2KMnO4 + 4H2O → 2KOH + 2MnO2 + 3C3H6(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
5.2. Tính chất hóa học của KMnO4
Vì là chất oxi hóa mạnh nên KMnO4 có thể phản ứng với kim loại hoạt động mạnh, axit hay các hợp chất hữu cơ dễ dàng.
Phản ứng phân hủy bởi nhiệt độ cao
- 2KMnO4 → K2MnO4 + MnO2 + O2
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
- 4KMnO4 + 2H2O → 4KOH + 4MnO2 + 3O2
Phản ứng với axit
KMnO4 có thể phản ứng với nhiều axit mạnh như H2SO4, HCl hay HNO3, các phương trình phản ứng minh họa gồm:
- 2 KMnO4+ H2SO4 → Mn2O7 + K2SO₄ + H2O
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- 3K2MnO4 + 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O
Phản ứng với bazơ
Thuốc tím có thể tác dụng với nhiều dung dịch kiềm hoạt động mạnh như KOH, NaOH, phương trình phản ứng minh họa:
- 4KMnO4 + 4KOH → 4K2MnO4 + 2H2O + O2
- 4KMnO4 4NaOH + → 2K2MnO4 + 2Na2MnO4 + 2H2O + O2
Tính chất oxy hóa của KMnO4
Vì thuốc tím là chất oxy hóa mạnh nên có thể phản ứng với nhiều loại dung dịch và cho ra nhiều sản phẩm khác nhau.
Trong môi trường axit, mangan bị khử thành Mn2+
- 2KMnO4+ 5Na2SO3 + 3H2SO4? 2MnSO4 + 5Na2SO₄ + K2SO4 + 3H2O
Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
- 2KMnO4 + 3K2SO3 + H2O ? 3K2SO4+2MnO2 + 2KOH
Trong môi trường kiềm, bị khử thành MnO42-
- 2KMnO4 + Na2SO3 + 2KOH ? 2K2MnO4 + Na2SO4 + H2O
Phản ứng với các hợp chất hữu cơ
Phản ứng với etanol
- 4KMnO4 + 3C2H5OH → 3CH3COOH + 4MnO2 + 4KOH + H2O
Phản ứng với axetilen trong môi trường kiềm:
- C2H2 + 10KMnO4 + 14KOH → 10K2MnO4 + 2K2CO3 + 8H2O
Phản ứng với axetilen trong môi trường trung tính:
- 3C2H2 + 10KMnO4 + 2KOH → 6K2CO3 + 10MnO2 + 4H2O
Phản ứng với axetilen trong môi trường axit
- C2H2 + 2KMnO4 + 3H2SO4 → 2CO2 + 2MnSO4 + K2SO4 + 4H20
KMnO4 phản ứng với Ethylene trong môi trường kiềm:
- 12KMnO4 + C2H4 + 16KOH → 12K2MnO4 + 2K2CO3 + 10H2O
KMnO4 phản ứng với Ethylene trong môi trường trung tính
- 4KMnO4 + C2H4 → 2K2CO3 + 4MnO2 + 2H2O
Phản ứng với glycerol
- 14KMnO4 + 4C3H8O3 → 7K2CO3 + 7Mn2O3 + 5CO2 + 16H2O
Các phản ứng khác của KMnO4
Thuốc tím tác dụng với H2O2
- 2KMnO4 + 3H2O2 → 2KOH + 2MnO2 + 3O2+ 2H2O
KMnO4 tác dụng với H2S
- 2KMnO4 + 3H2SO4 + 5H2S → 5S + 8H2O + K2SO4 + 2Mn
6. Bạn có biết
- Phản ứng trên gọi là phản ứng oxi hóa không hoàn toàn.
- Tương tự etilen, các anken đều làm mất màu dung dịch thuốc tím.
- Phản ứng này dung để phân biệt anken và
5. Tính chất hóa học
5.1. Tính chất hóa học của C3H6
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
Phản ứng cộng axit hoặc nước vào propen thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
- Cộng Brom
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
b. Phản ứng trùng hợp
- Propen trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Propen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C3H6 + O2 → 3CO2 + 3H2O
- Propen làm mất màu dung dịch KMnO4:
3C3H6 + 2KMnO4 + 4H2O → 2KOH + 2MnO2 + 3C3H6(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
ankan.
7. Bài tập liên quan
Ví dụ 1: Để làm sạch propan có lẫn propilen ta có thể cho hỗn hợp đi qua lượng dư dung dịch nào sau đây?
A. NaOH.
B. KMnO4.
C. AgNO3/NH3.
D. Cả A, B, và C.
Hướng dẫn
KMnO4 phản ứng với etilen còn etan không phản ứng.
Đáp án B.
Ví dụ 2: Anken A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,81MA. CTPT của A là:
A. C2H4
B. C3H6
C. C4H8
D. C5H10
Hướng dẫn
anken có CTPT là CnH2n thì điol thu được có công thức CnH2n(OH)2
→ 14n + 34 = 1,81 . 14n
→ n = 3
Đáp án B.
Ví dụ 3: Thổi 0,25 mol khí propilen qua 125ml dung dịch KMnO4 1M trong môi trường trung tính(hiệu suất 100%) khối lượng etylenglicol thu được bằng
A. 11,625g.
B. 23,25g.
C. 15,5g.
D. 31g.
Hướng dẫn:
nKMnO4 = 0,125
→ Hết
→ n = 0,125.3:2 = 0,1875
→ m = 0,1875.62 = 11,625
Đáp án A.
8. Một số phương trình phản ứng hóa học khác của Anken và hợp chất
CH3-CH=CH–CH3 + H2 → CH3–CH2–CH2–CH3
CH2=CH–CH2–CH3 + H2 → CH3–CH2–CH2–CH3
CH2 = C(CH3)–CH3 + H2 → CH3–CH(CH2)–CH3
CH2=CH–CH2– CH3 + Br2 → CH2Br–CH2Br–CH2 - CH3
CH3-CH=CH–CH3 + Br2 → CH3-CHBr–CHBr-CH3