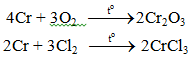Chúng tôi xin giới thiệu phương trình Cr + H2SO4 → CrSO4 + H2 ↑ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Crom. Mời các bạn đón xem:
Phương trình Cr + H2SO4 → CrSO4 + H2 ↑
1. Phương trình phản ứng hóa học:
Cr + H2SO4 → CrSO4 + H2 ↑
2. Hiện tượng nhận biết phản ứng
- Thấy có khí thoát ra.
3. Điều kiện phản ứng
- Đun nóng.
4. Tính chất hoá học
4.1. Tính chất hoá học của Crom
- Là kim loại có tính khử mạnh hơn sắt.
- Trong các hợp chất crom có số oxi hoá từ +1 → +6 (hay gặp +2, +3 và +6).
Tác dụng với phi kim
Tác dụng với nước
Cr bền với nước và không khí do có lớp màng oxit rất mỏng, bền bảo vệ. Người ta mạ crom lên sắt để bảo vệ sắt và dùng Cr để chế tạo thép không gỉ.
Tác dụng với axit
Cr + 2HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Cr không tác dụng với dung dịch HNO3 hoặc H2SO4 đặc, nguội.
4.2. Tính chất hoá học của H2SO4
a. Axit sunfuric loãng
- Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb)
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo
FeO + H2SO4 → FeSO4 + H2O
- Tác dụng với bazo
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Tác dụng với muối
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
b. Axit sunfuric đặc
- Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Cách thực hiện phản ứng
- Cho Crom vào ống nghiệm chứa axit H2SO4 loãng và đun nóng.
6. Bạn có biết
- Crom tác dụng được với HCl và H2SO4 nhưng không tan ngay trong dung dịch axit H2SO4 và HCl loãng và nguội mà phải đun nóng vì crom có màng oxit.
7. Bài tập liên quan
Ví dụ 1: Phát biểu nào sau đây sai:
A. CrO3 là một oxit axit
B. Cr(OH)3 tan được trong dung dịch NaOH
C. Cr phản ứng với H2SO4 loãng nóng tạo thành Cr3+
D. Trong môi trường kiềm, Br2 oxi hóa CrO2- thành CrO4-
Hướng dẫn giải
Đáp án C
Cr + H2SO4 → CrSO4 + H2 ↑
Ví dụ 2: Cho 13.5 gam hỗn hợp các kim loại Al, Fe, Cr tác dụng với lượng dư dung dịch H2SO4 loãng nóng thu được dung dịch X và 7.84 lít khí H2 ở đktc. Khối lượng của dd X là
A. 70.7g
B. 80.7g
C. 90.7g
D. 100.7g
Hướng dẫn giải
Đáp án B
nH2 = 0.35 mol
Áp dụng định luật bảo toàn nguyên tố H ta có
nH2 = nH2SO4 = 0.35 mol
Áp dụng định luật bảo toàn khối lượng ta có
m Kl + m H2SO4 = m ddX + m H2
⇔ 13.5 + 0.35 x 98 = m ddX + 0.35 x 2
⇒ m ddX = 80.7g
Ví dụ 3: Cho 10.4 gam crom tác dụng với dung dịch H2SO4 loãng, nóng dư thu được V (l) H2 ở đktc. Giá trị của V là
A. 2.24(l)
B. 3.36(l)
C. 4.48(l)
D. 6.72(l)
Hướng dẫn giải
Đáp án C
n Cr = 0.2 mol
Cr + H2SO4 → CrSO4 + H2 ↑
0.2 0.2
⇒ VH2 = 0.2 x 22. 4 = 4.48(l).
8. Một số phương trình phản ứng hoá học khác của Crom (Cr) và hợp chất:
2Cr + 6H2SO4(đặc) → Cr2(SO4)3 + 3SO2 ↑ + 6H2O
Cr + 6HNO3(đặc) → Cr(NO3)3 + 3NO2 ↑ + 3H2O