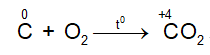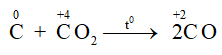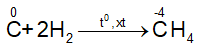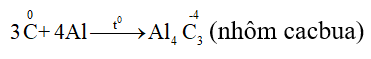Chúng tôi xin giới thiệu phương trình 2Al2O3 + 9C 
Phương trình 2Al2O3 + 9C 
1. Phương trình phản ứng hóa học:
2Al2O3 + 9C 
2. Hiện tượng nhận biết phản ứng
- Tạo kết tủa vàng Al4C3 và khí không màu.
3. Điều kiện phản ứng
- Điều kiện nhiệt độ cao.
4. Tính chất hoá học
a. Tính chất hoá học của Al2O3
- Al2O3 là oxit lưỡng tính.
+ Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
- Al2O3 tác dụng với C
Al2O3 + 9C 
b. Tính chất hoá học của Cacbon
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
Tính khử
- Tác dụng với oxi
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
Tính oxi hóa
- Tác dụng với hidro
- Tác dụng với kim loại
5. Cách thực hiện phản ứng
- Nung hỗn hợp Al2O3 và C ở trên 20000C.
6. Bạn có biết
- Các oxit của kim loại khác đứng sau Al cũng phản ứng với C nhưng sinh khí CO và kim loại đó.
7. Bài tập liên quan
Ví dụ 1: Cho Al2O3 + 9C 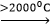
A. Al và CO.
B. Al4C3 và CO.
C. Al và CO2
D. Al.
Hướng dẫn giải
Chọn B.
2Al2O3 + 9C 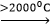
Ví dụ 2: Nung hỗn hợp Al2O3 và C phản ứng vừa đủ thu được muối Al4C3, cho toàn bộ lượng muối vào nước thu được 1,12 lít khí không màu. Hỏi khối lượng hỗn hợp Al2O3 và C ban đầu?
A. 46,2 gam.
B. 46,8 gam.
C. 42,6 gam.
D. 48,6 gam.
Hướng dẫn giải
Chọn B.
2Al2O3 + 9C 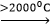
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑ (2)
Theo bài ta có, khí không màu là CH4: nCH4=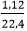
Theo phương trình phản ứng (2) ta có: nAl4C3=3nCH4=3.0,05=0,15 mol
Theo phương trình phản ứng (1) ta có:
nAl2O3=2nAl4C3=0,3 mol và nC=9nAl4C3=9.0,15=1,35 mol
Vậy mhh = 0,3.102 + 1,35.12 = 46,8 gam.
Ví dụ 3:Trong các phản ứng dưới đây, phản ứng nào xảy ra được?
A. Cu + HCl →
B. Fe + HNO3(đặc, nguội) →
C. Al2O3 + C
D. NaNO3 + AgNO3 →
Hướng dẫn giải
Chọn C.
2Al2O3 + 9C 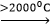
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O