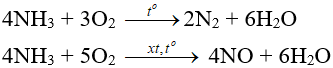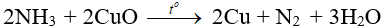Chúng tôi xin giới thiệu phương trình HCHO + AgNO3 + NH3 + H2O → Ag + NH4NO3 + (NH4)2CO3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình HCHO + AgNO3 + NH3 + H2O → Ag + NH4NO3 + (NH4)2CO3
1. Phương trình phản ứng hóa học
HCHO + 4AgNO3 + 6NH3 + 2H2O → 4Ag + 4NH4NO3 + (NH4)2CO3
2. Hiện tượng nhận biết phản ứng.
- Có kết tủa trắng Ag, có khí thoát ra chính là NH4NO3
3. Điều kiện phản ứng
- Không có
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của HCHO (Andehit fomic)
- Trong phản ứng trên HCHO là chất khử.
- HCHO mang đầy đủ tính chất hoá học đặc trưng của một andehit nên có phản ứng tráng gương.
b. Bản chất của AgNO3 (Bạc nitrat)
- Trong phản ứng trên AgNO3 là chất oxi hoá.
- AgNO3 có tính oxi hoá mạnh tác dụng với HCHO tạo kết tủa trắng Ag và khí NH4NO3 thoát ra.
5. Tính chất hóa học
5.1. Tính chất hóa học của HCHO
a. Phản ứng với hiđro
R(CHO)x + xH2 → R(CH2OH)x (xúc tác Ni, t0)
Chú ý:
- Trong phản ứng của anđehit với H2: Nếu gốc R có các liên kết pi thì H2 cộng vào cả các liên kết pi đó.
- Phản ứng với H2 chứng tỏ anđehit có tính oxi hóa.
b. Phản ứng với AgNO3/NH3 (phản ứng tráng bạc)
R(CHO)x + 2xAgNO3 + 3xNH3 + xH2O → R(COONH4)x + xNH4NO3 + 2xAg
- Phản ứng chứng minh anđehit có tính khử và được dùng để nhận biết anđehit.
- Riêng HCHO có phản ứng:
HCHO + 4AgNO3 + 6NH3 + 2H2O → (NH4)2CO3 + 4NH4NO3 + 4Ag
Chú ý:
- Phản ứng tổng quát ở trên áp dụng với anđehit không có nối ba nằm đầu mạch. Nếu có nối ba nằm ở đầu mạch thì H của C nối ba cũng bị thay thế bằng Ag.
- Các đặc điểm của phản ứng tráng gương của anđehit:
+ Nếu nAg = 2nanđehit → anđehit thuộc loại đơn chức và không phải HCHO.
+ Nếu nAg = 4nanđehit → anđehit đó thuộc loại 2 chức hoặc HCHO.
+ Nếu nAg > 2nhỗn hợp các anđehit đơn chức thì hỗn hợp đó có HCHO.
+ Số nhóm CHO = nAg/2nanđehit (nếu trong hỗn hợp không có HCHO).
- Một số loại chất khác cũng có khả năng tham gia phản ứng tráng gương gồm:
+ HCOOH và muối hoặc este của nó: HCOONa, HCOONH4, (HCOO)nR. Các chất HCHO, HCOOH, HCOONH4 khi phản ứng chỉ tạo ra các chất vô cơ.
+ Các tạp chức có chứa nhóm chức CHO: glucozơ, fructozơ, mantozơ…
c. Phản ứng oxi hóa
a. Oxi hóa hoàn toàn
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
Nếu đốt cháy anđehit mà nCO2 = nH2O thì anđehit thuộc loại no, đơn chức, mạch hở.
CnH2n+1CHO → (n + 1)CO2 + (n + 1)H2O
b. Phản ứng oxi hóa không hoàn toàn
R(CHO)x + x/2O2 → R(COOH)x (xúc tác Mn2+, t0)
Đối với bài toán oxi hóa anđehit thành axit cần chú ý định luật bảo toàn khối lượng trong quá trình giải.
d. Phản ứng với Cu(OH)2 ở nhiệt độ cao
R(CHO)x + 2xCu(OH)2↓ → R(COOH)x + xCu2O↓ + 2xH2O
xanh đỏ gạch
→ Phản ứng này được dùng để nhận biết anđehit.
Chú ý: Phản ứng với Cu(OH)2 thường được thực hiện trong môi trường kiềm nên có thể viết phản ứng dưới dạng:
R(CHO)x + 2xCu(OH)2 + xNaOH → R(COONa)x + xCu2O + 3xH2O
HCOOH, HCOOR, HCOOM, glucozơ, fructozơ, mantozơ cũng có phản ứng này.
e. Phản ứng với dung dịch Br2
R(CHO)x + xBr2 + xH2O → R(COOH)x + 2xHBr
Nếu anđehit còn có liên kết pi ở gốc hiđrocacbon thì xảy ra đồng thời phản ứng cộng Br2 vào liên kết pi đó.
5.2. Tính chất hóa học của AgNO3
- Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
5.3. Tính chất hóa học của NH3
Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
5.4. Tính chất hóa học của H2O
- Nước tác dụng với kim loại
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
- Nước tác dụng với oxit bazo
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịc bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
- Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
6. Cách thực hiện phản ứng
- Cho HCHO tác dụng với dung dịch AgNO3/NH3.
7. Bạn có biết
- Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
8. Bài tập liên quan
Câu 1: Chia a gam axit axetic thành 2 phần bằng nhau:
Phần 1: trung hòa vừa đủ bởi 0,5 lít dung dịch NaOH 0,4 M
Phần 2: thực hiện phản ứng este hóa với ancol etylic thu được m gam este ( giả sử hiệu suất phản ứng là 100%)
Vậy m có giá trị là:
A. 16,7 gam
B. 17,6 gam
C. 16,8 gam
D. 18,6 gam
Lời giải:
Đáp án: B
Giải thích:
nNaOH= 0,2 mol
Phương trình hóa học:
CH3COOH + NaOH → CH3COONa + H2O
0,2 <--------0,2
=> mCH3COOH = 0,2.60 = 12 g
=> nCH3COOH = 0,2 (2 phần bằng nhau)
Phương trình hóa học:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
0,2 -----------→ 0,2
=> m = 0,2.88 = 17,6 g
Câu 2. Để tách các chất ra khỏi nhau từ hỗn dung dịch chứa axit axetic và ancol etylic, có thể tiến hành theo trình tự nào sau đây?
A. Dùng CaCO3, chưng cất, sau đó tác dụng với H2SO4
B. Dùng CaCCl2, chưng cất, sau đó tác dụng với H2SO4
C. Dùng Na2O, sau đó cho tác dụng với H2SO4
D. Dùng NaOH, sau đó cho tác dụng với H2SO4
Lời giải:
Đáp án: A
Giải thích:
Cho hỗn hợp tác dụng với CaCO3, sau đó chưng cất được etyl axetat.
2CH3COOH + CaCO3→ (CH3COO)2Ca + H2O + CO2
Chất rắn không bay hơi cho tác dụng với H2SO4, sau đó chưng cất thu được CH3COOH.
(CH3COO)2Ca + H2SO4 → 2CH3COOH + CaSO4
Câu 3. Ứng dụng nào sau đây không phải của HCHO.
A. Dùng để sản xuất nhựa phenol-fomanđehit.
B. Dùng để sản xuất nhựa ure-fomanđehit.
C . Dùng để tẩy uế, ngâm mẫu động vật.
D. Dùng để sản xuất axit axetic.
Lời giải:
Đáp án: D
Câu 4. Cho 5,8 gam anđehit đơn chức X phản ứng hoàn toàn với một lượng dư Ag2O (hoặc AgNO3) trong dung dịch NH3 đun nóng, thu được m gam Ag. Hoà tan hoàn toàn m gam Ag bằng dung dịch HNO3 đặc, sinh ra 4,48 lít NO2 (sản phẩm khử duy nhất, ở đktc). Công thức của X là
A. C3H7CHO.
B. C4H9CHO.
C. HCHO.
D. C2H5CHO
Lời giải:
Đáp án: D
Giải thích:
Ag + 2HNO3 → AgNO3 + NO2 + H2O
0,2 0,2
R-CHO → 2Ag
0,1 ← 0,2.
MRCHO = 5,8/0,1 = 58
R+ 29 = 58 → R= 29 (C2H5)
Câu 5. Cho các nhận định sau:
(a) Anđehit là hợp chất chỉ có tính khử.
(b) Anđehit cộng hiđro thành ancol bậc một.
(c) Anđehit tác dụng với AgNO3/NH3tạo thành Ag.
(d) Anđehit no, đơn chức, mạch hở có công thức tổng quát CnH2nO.
Số nhận định đúng là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án: C
Giải thích:
(a) Sai vì anđehit là hợp chất vừa có tính oxi hóa và tính khử.
Thí dụ:
Tính khử của andehit
CH3CHO + H2→ CH3CH2OH.
Tính oxi hóa
CH3CHO + 2AgNO3+ 3NH3 + H2O → CH3COONH4 + 2NH4NO3 + 2Ag
(b) Đúng
(c) Đúng
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2NH4NO3 + 2Ag
(d) Đúng
Câu 6. Cho chất anđehit fomic (HCHO) và axit axetic (CH3COOH), hãy chọn nhận xét đúng trong các nhận xét sau:
A. Hai chất đó giống nhau về công thức phân tử và khác nhau về công thức đơn giản nhất.
B. Hai chất đó khác nhau về công thức phân tử và giống nhau về công thức đơn giản nhất.
C. Hai chất đó khác nhau về công thức phân tử và khác nhau về công thức đơn giản nhất.
D. Hai chất đó có cùng công thức phân tử và cùng công thức đơn giản nhất.
Lời giải:
Đáp án: B
Giải thích:
Công thức đơn giản nhất của anđehit fomic: CH2O
Công thức đơn giản nhất của axit axetic: CH2O
=> 2 chất khác nhau về công thức phân tử và giống nhau về công thức đơn giản nhất
Câu 7. Dãy gồm các chất đều phản ứng với phenol là:
A. nước brom, anđehit axetic, dung dịch NaOH.
B. nước brom, axit axetic, dung dịch NaOH.
C. dung dịch NaCl, dung dịch NaOH, kim loại Na.
D. nước brôm, anhidrit axetic, dung dịch NaOH.
Lời giải:
Đáp án: D
Giải thích:
Dãy gồm các chất đều phản ứng với phenol là: nước brôm, anhidrit axetic, dung dịch NaOH.
C6H5OH + 3Br2→ C6H2Br3OH + 3HBr
C6H5OH + (CH3CO)2O ⟶ CH3COOH + CH3COOC6H5
C6H5OH + NaOH → C6H5ONa + H2O
Câu 8. Có bao nhiêu anđehit 2 chức có công thức đơn giản là C2H3O?
A. 2
B. 4
C. 1
D. 3
Lời giải:
Đáp án: A
Giải thích:
Hướng dẫn Anđehit 2 chức có 2 nhóm –CHO => phân tử có 2 nguyên tử O
=> CTPT: C4H6O2
Có 2 công thức thỏa mãn là
OHC-CH2-CH2-CHO
CH3-CH(CHO)2
Câu 9. Nguồn nguyên liệu chính dùng để sản xuất anđehit axetic trong công nghiệp là
A. etanol.
B. etan.
C. axetilen.
D. etilen.
Lời giải:
Đáp án: D
Giải thích:
Nguồn nguyên liệu chính để sản xuất anđehit axetic trong công nghiệp là etilen
2CH2=CH2 + O2 2CH3CHO
Câu 10. Để trung hòa 6,72 gam một axit cacboxylic Y (no, đơn chức), cần dùng 200 gam dung dịch NaOH 2,24%. Công thức của Y là
A. CH3COOH.
B. HCOOH.
C. C2H5COOH.
D. C3H7COOH.
Lời giải:
Đáp án: A
Giải thích:
Hướng dẫn nNaOH = 0,112 mol
Y là axit no, mạch hở => nRCOOH = nNaOH = 0,112 mol
=> M = 6,72 / 0,112 = 60 => Y là CH3COOH
9. Một số phương trình phản ứng hoá học khác của Hiđro và hợp chất:
HCHO + AgNO3 + NH3 + H2O → Ag + NH4NO3 + (NH4)2CO3