Chúng tôi xin giới thiệu phương trình 2Al2O3 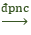
Phương trình 2Al2O3 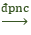
1. Phương trình điện phân nóng chảy (đpnc):
2Al2O3 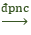
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- Điều kiện 900oC, điện phân nóng chảy.
4. Tính chất hoá học
a. Tính chất hoá học của Al2O3
- Al2O3 là oxit lưỡng tính.
+ Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
- Al2O3 tác dụng với C
Al2O3 + 9C 
5. Cách thực hiện phản ứng
- Điện phân nóng chảy Al2O3.
6. Bạn có biết
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua tương ứng:
2MCln 
7. Bài tập liên quan
Ví dụ 1: Dãy kim loại nào dưới đây điều chế được bằng cách điện phân nóng chảy muối clorua ?
A. Al, Mg, Fe
B. Al, Mg, Na.
C. Na, Ba, Mg
D. Al, Ba, Na.
Hướng dẫn giải
Chọn C.
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua tương ứng:
2MCln 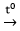
Tuy nhiên, Al được điều chế bằng cách điện phân nóng chảy Al2O3:
2Al2O3 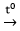
Ví dụ 2: Để sản xuất nhôm trong công nghiệp người ta thường:
A. Điện phân dung dịch AlCl3
B. Cho Mg vào dung dịch Al2(SO4)3.
C. Cho CO dư đi qua Al2O3 nung nóng
D. Điện phân Al2O3 nóng chảy có mặt criolit.
Hướng dẫn giải
Chọn D.
2Al2O3 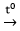
Ví dụ 3: Giải thích tại sao để điều chế Al người ta điện phân Al2O3 nóng chảy mà không điện phân AlCl3 nóng chảy là:
A. AlCl3 nóng chảy ở nhiệt độ cao hơn Al2O3.
B. AlCl3 là hợp chất cộng hóa trị nên không nóng chảy mà thăng hoa.
C. Điện phân AlCl3 tạo ra Cl2 rất độc.
D. Điện phân Al2O3 cho ra Al tinh khiết hơn.
Hướng dẫn giải
Chọn B.
Trên 180oC thì AlCl3 đã thăng hoa và nhị hợp thành Al2Cl6 nên không điện phân được nữa.
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O

 Al4C3 + 6CO
Al4C3 + 6CO