Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 40: Nhận biết một số ion trong dung dịch chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Nhận biết một số ion trong dung dịch lớp 12.
Bài giảng Hóa học 12 Bài 40: Nhận biết một số ion trong dung dịch
Giải bài tập Hóa học 12 Bài 40: Nhận biết một số ion trong dung dịch
Câu hỏi và bài tập (trang 174 SGK Hóa Học 12)
Bài 1 trang 174 SGK Hóa Học 12: Có 3 dung dịch, mỗi dung dịch chứa 1 cation sau: Ba2+, NH4+, Al3+. Trình bày cách nhận biết chúng
Lời giải:
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng
- Nhỏ lần lượt vào mỗi ống nghiệm từ từ từng giọt dung dich NaOH đến dư:
+ ống nghiệm nào có khí mùi khai thoát ra => chứng tỏ chứa NH4+
NH4+ + NaOH → Na+ + NH3 ↑ + H2O
+ ống nghiệm nào xuất hiện kết tủa trắng keo đến cực đại, sau đó kết tủa tan hoàn toàn => chứng tỏ chứa Al3+.
NaOH + Al3+ → Al(OH)3 ↓ + Na+
NaOH + Al(OH)3 → NaAlO2 + H2O
- Cho dd H2SO4 vào dung dịch còn lại, thấy có xuất hiện kết tủa trắng (không tan trong axit) => chứng tỏ chứa Ba2+
+ Ba2+ → BaSO4↓
Bài 2 trang 174 SGK Hóa Học 12: Dung dịch A chứa đồng thời các cation Fe2+, Al3+. Trình bày cách tách và nhận biết mỗi ion từ dung dịch A.
Lời giải:
Cách tách 2 ion từ hỗn hợp:
- Cho NaOH đến dư vào hỗn hợp ta thu được hai phần : kết tủa là Fe(OH)3, dung dịch X là NaAlO2, NaOH dư
Fe2+ + 2NaOH → 2Na+ + Fe(OH)2
4 Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3
Al3+ + 3NaOH → 2Na+ + Al(OH)3↓
Al(OH)3↓ + NaOH→ NaAlO2 + H2O
+ Tách kết tủa Fe(OH)3 hòa tan trong HCl thu muối Fe3+
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
+ Cho Fe vào dung dịch thu được bên trên (FeCl3, HCl dư) ta thu được muối Fe2+
Fe + 2HCl → FeCl2 + H2↑
Fe + 2FeCl3 → 3FeCl2
+ Phần dung dịch X dẫn qua CO2 đến dư thu được kết tủa Al(OH)3
NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
Hòa tan kết tủa trong HCl thu muối Al3+
Al(OH)3 + 3HCl→ AlCl3 + 3H2O
- Nhận biết mỗi ion từ hỗn hợp
Cho NaOH vào hỗn hợp hai cation, nếu thấy xuất hiện kết tủa trắng xanh là Fe(OH)2, đem để ngoài không khí thấy có kết tủa nâu đỏ đó là Fe(OH)3. => chứng tỏ có ion Fe2+
Nếu thấy dung dịch có kết tủa keo trắng sau đó tan ra trong NaOH dư => chứng tỏ có Al3+.
Bài 3 trang 174 SGK Hóa Học 12: Có 5 dung dịch riêng rẽ, mỗi dung dịch chứa 1 cation: NH4+, Mg2+, Fe3+, Al3+, Na+ nồng độ khoảng 0,1 M. Bằng cách dùng dung dịch NaOH cho lần lượt vào từng dung dịch, có thể nhận biết được tối đa:
A. Dung dịch chứa ion: NH4+
B. Hai dung dịch chứa ion: NH4+ và Al3+
C. Ba dung dịch chứa ion: NH4+ , Fe3+ và Al3+
D. Năm dung dịch chứa ion: NH4+, Mg2+, Fe3+, Al3+, Na+
Phương pháp giải:
Dựa vào hiện tượng khác nhau khi cho dd NaOH vào các catinon trên để nhận biết chúng.
+ xuất hiện kết tủa, màu sắc kết tủa,kết tủa tan hay không tan khi cho NaOH dư
+ khí thoát ra
Lời giải:
Cho từ từ đến dư dung dịch NaOH vào từng ống nghiệm trên
+ ống nghiệm nào có khí mùi khai thoát ra => chứa NH4+
NH4+ + OH - → NH3↑ + H2O
+ ống nghiệm nào xuất hiện kết tủa màu trắng, kết tủa không tan trong dung dịch NaOH dư => chứa Mg2+
Mg2+ + 2OH- → Mg(OH)2↓
+ ống nghiệm nào xuất hiện kết tủa màu nâu đỏ => chứa Fe3+
Fe3+ + 3OH- → Fe(OH)3↓
+ ống nghiệm nào xuất hiện kết tủa keo trắng, sau đó kết tủa tan dần đến hết => chứa Al3+
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3↓ + OH- → AlO2- + 2H2O
+ ống nghiệm nào không có hiện tượng gì là Na+
Vậy phân biệt được cả 5 ion
Đáp án D
Bài 4 trang 174 SGK Hóa Học 12: Có 2 dung dịch riêng rẽ chứa các anion: NO3-, CO32-. Hãy nêu cách nhận biết từng ion trong dung dịch đó. Viết phương trình hóa học.
Lời giải:
Lấy mỗi dung dịch một ít cho vào 2 ống nghiệm:
- Nhỏ dung dịch HCl hay dung dịch H2SO4 loãng vào, ống nào thấy sủi bọt là dung dịch có chứa ion CO32-.
2H+ + CO32- → CO2 ↑+ H2O
- Cho vào ống còn lại vài giọt dung dịch H2SO4 và một lá đồng rồi đun nóng, khi có màu nâu đỏ thoát ra chứng tỏ dung dịch có ion chứa ion NO3-.
3Cu + 4H+ + 2NO3- → 3Cu2+ + 2NO↑ + 2H2O
2NO + 2O2 → NO2 (màu nâu đỏ)
Bài 5 trang 174 SGK Hóa Học 12: Có dung dịch chứa các anion: CO32- và SO42-. Hãy nêu cách nhận biết từng ion trong dung dịch đó. Viết phương trình hóa học.
Phương pháp giải:
Dùng dd axit nhận biết ra CO32- vì có khí thoát ra ngoài
Nhận biết SO42- bằng muối Ba2+ vì xuất hiện kết tủa trắng
Lời giải:
Lấy mỗi dung dịch một ít cho vào 2 ống nghiệm:
- Cho dd H2SO4 loãng vào 2 ống nghiệm trên:
+ ống nghiệm nào có khí thoát ra => chứng tỏ chứa CO32-
2H+ + CO32- → CO2 ↑+ H2O
- Cho dd BaCl2 vào dung dịch còn lại thấy xuất hiện kết tủa trắng. Nhỏ thêm vào đó vài giọt dung dịch HCl hay dung dịch H2SO4 loãng, lắc nhẹ ống nghiệm thấy có kết tủa không tan chứng tỏ có BaSO4 => chứng tỏ chứa SO42-
Ba2+ + SO42- → BaSO4↓
Bài 6 trang 174 SGK Hóa Học 12: Có 5 dung dịch hóa chất không nhãn, mỗi dung dịch nồng độ khoảng 0,1 M của một trong các muối sau: KCl, Ba(HCO3)2, K2CO3, K2S, K2SO4.
Chỉ dùng dung dịch H2SO4 loãng, nhỏ trực tiếp vào từng dung dịch, thì có thể nhận biết được tối đa những sung dịch nào?
A. Hai sung dịch: . Ba(HCO3)2, K2CO3
B. Ba dung dịch: . Ba(HCO3)2, K2CO3 , K2S
C. Hai dung dịch: . Ba(HCO3)2, K2S
D. Hai dung dịch: . Ba(HCO3)2, K2SO4.
Lời giải:
Cho dd lần lượt vào 5 lọ đựng 5 dung dịch
+ Lọ nào có kết tủa trắng, có khí không màu không mùi bay lên là Ba(HCO3)2
Ba(HCO3)2 + H2SO4 → BaSO4 + 2CO2↑ + 2H2O
+ Lọ nào có khí mùi trứng thối là K2S.
K2S + H2SO4 → K2SO4 + H2S↑
+ Lọ nào chỉ có khí không màu không mùi là K2CO3
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
Đáp án B
Lý thuyết Bài 40: Nhận biết một số ion trong dung dịch
A. NHẬN BIẾT CATION
I. NGUYÊN TẮC NHẬN BIẾT
Để nhận biết 1 ion trong dung dịch, người ta thêm vào dung dịch 1 thuốc thử tạo với ion đó 1 sản phẩm đặc trưng như: chất kết tủa, hợp chất có màu, chất khí, sủi bọt, ……
II. NHẬN BIẾT CATION KIM LOẠI KIỀM VÀ ION NH4+
1. Nhận biết cation Na+
Đốt muối natri rắn hoặc các dung dịch muối bằng ngọn lửa không màu thì ngọn lửa nhuốm màu vàng tươi.
2. Nhận biết cation K+
Đốt muối kali rắn hoặc các dung dịch muối kali, ta được ngọn lửa màu tím.
3. Nhận biết ion NH4+
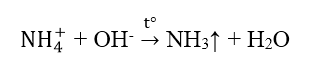
III. NHẬN BIẾT CATION Ca2+, Ba2+
1. Nhận biết cation Ba2+: dùng dung dịch thuốc thử K2CrO4 hoặc K2Cr2O7
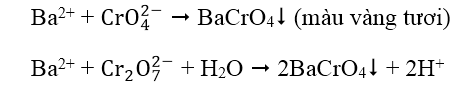
BaCrO4 không tan trong dung dịch CH3COOH loãng, nên trong môi trường axit axetic có thể phân biệt được Ba2+ trong dung dịch chứa Ca2+.
2. Nhận biết cation Ca2+
- Trong môi trường axit yếu (pH = 4 - 5). Dung dịch chứa ion CrO42- tạo kết tủa với ion Ca2+ khí tan trong dung dịch CH3COOH loãng.
- Chú ý: Các ion Ba2+ và Pb2+ cũng phản ứng tương tự, nên cần tách chúng trước khi nhận biết Ca2+ nếu trong dung dịch có chúng.
IV. NHẬN BIẾT CATION Al3+, Cr3+
- Thêm từ từ dung dịch kiềm vô dung dịch chứa các ion này, đầu tiên tạo các hiđroxit M(OH)3 kết tủa, sau đó kết tủa tan trong thuốc thử dư:
M3+ + 3OH- → M(OH)3↓
M(OH)3 + OH- → [M(OH)4]-
- Để phân biệt Al3+ và Cr3+ dùng thuốc thử nhóm gồm dung dịch kiềm KOH hoặc NaOH dư có mặt chất oxi hóa là H2O2 để oxi hóa [Cr(OH)4]- thành ion cromat CrO42- có màu vàng:
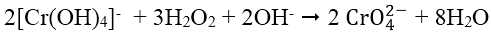
V. NHẬN BIẾT CATION Fe2+, Fe3+, Cu2+, Mg2+
1. Nhận biết cation Fe3+: dùng dung dịch thioxianua SCN-, hoặc dung dịch kiềm NaOH, KOH hoặc NH3.
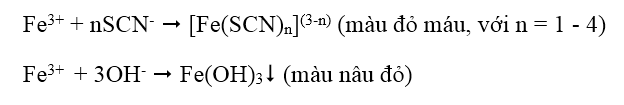
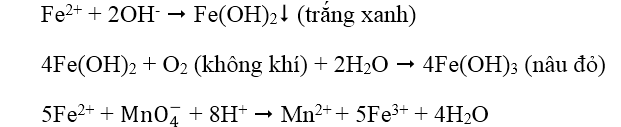
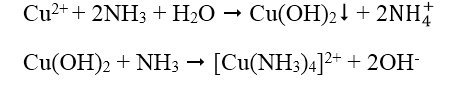
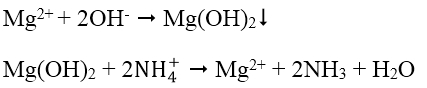
B. NHẬN BIẾT ANION
I. NHẬN BIẾT ANION NO3-
- Dùng Cu trong môi trường axit (dung dịch H2SO4 loãng):
3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
Cu tan ra tạo dung dịch màu xanh. Khí NO không màu bay lên gặp oxi trong không khí tạo thành NO2 màu nâu:
2NO + O2 → 2NO2↑ (màu nâu)
II. NHẬN BIẾT ANION SO42-
Dùng dung dịch BaCl2 trong môi trường axit loãng dư (dung dịch HCl hoặc HNO3)
Ba2+ + SO42- → BaSO4↓ (trắng, không tan trong dung dịch axit loãng)
III. NHẬN BIẾT ANION SO32-
Ion sunfit làm mất màu dung dịch I2 (màu nâu đỏ):
SO32- + I2 + H2O → SO42- + 2H+ + I-
IV. NHẬN BIẾT ANION Cl-
Ion clorua phản ứng với dung dịch AgNO3 tạo kết tủa AgCl màu trắng không tan trong môi trường axit:
Ag+ + Cl- → AgCl↓
V. NHẬN BIẾT ANION CO32-
Khi thêm dung dịch HCl hoặc H2SO4 vào dung dịch chứa anion cacbonat hoặc hiđro cacbonat sẽ có bọt khí CO2 bay lên làm vẩn đục nước vôi trong Ca(OH)2 dư:
CO32- + 2H+ → CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O

