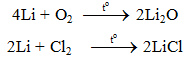Chúng tôi xin giới thiệu phương trình 4Li + O2 → 2Li2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình hóa học của Li. Mời các bạn đón xem:
Phương trình 4Li + O2 → 2Li2O
1. Phương trình phản ứng hóa học:
4Li + O2 → 2Li2O
2. Hiện tượng nhận biết phản ứng
Liti cháy sáng trong oxi cho ngọn lửa màu đỏ tía, phản ứng xảy ra mãnh liệt.
3. Điều kiện phản ứng
- Nhiệt độ.
4. Tính chất hóa học
- Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
a. Tác dụng với phi kim
b. Tác dụng với axit
- Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
c. Tác dụng với nước
- Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
d. Tác dụng với hidro
- Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
5. Cách thực hiện phản ứng
- Cho liti tác dụng với khí oxi thu được litioxit
6. Bạn có biết
Dùng phản ứng đốt cháy dựa vào màu sắc để nhận biết kim loại Li
7. Bài tập liên quan
Ví dụ 1: Cho 1,4 g liti tác dụng hết với oxi. Toàn bộ sản phẩm thu được đem hòa tan hết với nước thì thu được 160g dung dịch A. Tính nồng độ phẩn trăm của dung dịch A.
A. 3,5%
B. 7%
C. 3%
D. 14%
Đáp án: C
Hướng dẫn giải:
Phương trình phản ứng: Li + O2 → Li2O
Li2O + H2O → 2LiOH
nLiOH = nLi = 0,2 mol ⇒ mLiOH = 0,2.24 = 4,8 g
C%(LiOH) = 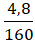
Ví dụ 2:Cho 1,4 g kim loại Li tác dụng hết với oxi. Thể tích oxi tham gia phản ứng (đktc)
A. 1,12 lít
B. 2,24 lít
C. 4,48 lít
D. 5,6 lít
Đáp án: A
Hướng dẫn giải:
Phương trình phản ứng 4Li + O2 → 2Li2O
nO2 = 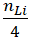
Ví dụ 3:Kim loại kiềm khi cháy trong oxi cho ngọn lửa màu đỏ tía
A. Li
B. Na
C. Rb
D. K
Đáp án: A
8. Một số phương trình phản ứng hóa học khác của Li: