Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 34: Crom và hợp chất của Crom chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Crom và hợp chất của Crom lớp 12.
Bài giảng Hóa học 12 Bài 34: Crom và hợp chất của Crom
Giải bài tập Hóa học 12 Bài 34: Crom và hợp chất của Crom
Câu hỏi và bài tập (trang 155 SGK Hóa Học 12)
Bài 1 trang 155 SGK Hóa Học 12: Viết phương trình hóa học của các phản ứng trong quá trình chuyển hóa sau:
Cr Cr2O3 Cr2(SO4)3 Cr(OH)3 Cr2O3.
Lời giải:
(1) 4Cr + 3O2 2Cr2O3
(2) Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O
(3) Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 + 3Na2SO4
(4) 2Cr(OH)3 Cr2O3 + 3H2O
Bài 2 trang 155 SGK Hóa Học 12: Cấu hình electron của Cr3+ là:
A. [Ar]3d5. B. [Ar]3d4.
C. [Ar]3d3. D. [Ar]3d2
Lời giải:
Cấu hình e của Cr ( Z = 24): [Ar] 3d54s1
=> Cấu hình electron của Cr3+ là: [Ar] 3d3
Đáp án C
Bài 3 trang 155 SGK Hóa Học 12: Số oxi hóa đặc trưng của Crom là :
A. +2, +4, +6. B. +2, +3, +6.
C. +1, +2, +4, +6. D. +3, +4, +6.
Lời giải:
Số oxi hóa đặc trưng của crom là +2, +3, +6
Đáp án B
Bài 4 trang 155 SGK Hóa Học 12: Hãy viết công thức của một số muối crom trong đó nguyên tố Crom:
a) đóng vai trò cation.
b) có trong thành phần của anion
Lời giải:
a) Crom đóng vai trò cation : CrCl2, Cr2(SO4)3.
b) Crom có trong thành phần của anion : K2CrO4, K2Cr2O7.
Bài 5 trang 155 SGK Hóa Học 12: Khi nung nóng 2 mol natri đicromat người ta thu được 48 gam oxi và 1 mol crom(III) oxit. Hãy viết phương trình hóa học của phản ứng và xét xem natri đicromat đã bị nhiệt phân hoàn toàn hay chưa
Lời giải:
(mol).
2 1 1,5(mol)
=> Na2Cr2O7 đã bị phân hủy hết.
Lý thuyết Bài 34: Crom và hợp chất của cromA. CROM
I. VỊ TRÍ, CẤU TẠO
- Crom thuộc nhóm VIB, chu kì 4, và là kim loại chuyển tiếp.
- Cấu hình e: 1s22s22p63s23p63d54s1
- Trong hợp chất, crom có số OXH biến đổi từ +1 đến +6. Phổ biến hơn cả là các số OXH +2, +3, +6
- Ở nhiệt độ thường, crom có cấu tạo mạng tinh thể lập phương tâm khối.
II. TÍNH CHẤT VẬT LÍ
- Crom có màu trắng ánh bạc, rất cứng (rạch được thuỷ tinh, cứng nhất trong số các kim loại, độ cứng chỉ kém kim cương)
- Khối lượng riêng lớn, khó nóng chảy (tnc 1890oC).
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
4 + 3O2 2
2 + 3Cl2 2
2. Tác dụng với axit
- Trong dung dịch HCl, H2SO4 loãng nóng, màng oxit bị phá huỷ, crom khử ion H+ tạo ra muối Cr(II) và khí hiđro.
+ 2HCl → + H2
- Chú ý: Tương tự nhôm, crom không tác dụng với axit HNO3 và H2SO4 đặc, nguội mà các axit này làm cho kim loại crom trở nên thụ động.
IV. ỨNG DỤNG
- Crom có nhiều ứng dụng thiết thực trong công nghiệp và trong đời sống.
- Trong công nghiệp, crom được dùng để sản xuất thép :
- Trong đời sống, nhiều đồ vật bằng thép được mạ crom. Lớp mạ crom vừa có tác dụng bảo vệ kim loại khỏi bị ăn mòn, vừa tạo vẻ đẹp cho đồ vật.
V. SẢN XUẤT
- Trong tự nhiên không có crom ở dạng đơn chất mà chỉ có ở dạng hợp chất (chiếm 0,03% khối lượng vỏ Trái Đất). Hợp chất phổ biến nhất của crom là quặng cromit sắt FeO.Cr2O3, quặng này thường có lẫn Al2O3 và SiO2.
B. HỢP CHẤT CỦA CROM
I. HỢP CHẤT CỦA Crom (II)
1. Crom(II) oxit, CrO
* Là oxit bazo có màu đen
* Tính chất hóa học đặc trưng: tính khử, tính chất của oxit bazo.
- Tính khử
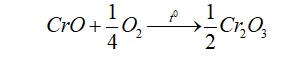
- Tính bazo: Tác dụng với HCl, H2SO4 loãng sinh ra muối crom (II) và nước
CrO + 2HCl → CrCl2 + H2O
2. Crom (II) hidroxit, Cr(OH)2
* Là chất rắn màu vàng và là 1 bazo
* Tính chất hóa học đặc trưng:
- Tính khử
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Tính bazo: tác dụng với dung dịch axit (HCl, H2SO4 loãng) sinh ra muối mới, nước
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
3. Muối crom(II)
- Muối crom (II) có tính khử mạnh
2CrCl2 + Cl2 → 2CrCl3
- Dung dịch muối Crom(II) để ngoài không khí sẽ chuyển từ màu xanh lam sang màu xanh lục
II. HỢP CHẤT CỦA CROM (III)
1. Crom (III) oxit Cr2O3
* Là oxit lưỡng tính có màu xanh lục, tan được trong dung dịch axit và kiềm đặc:
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
2. Hidroxit Cr(OH)3
* Là hidroxit lưỡng tính, kết tủa nhầy, màu lục nhạt tan được trong dung dịch axit và dung dịch kiềm.
Cr(OH)3 + NaOH → Na (hay NaCrO2) natri cromit
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
3. Muối crom (III)
- Muối crom(III) có tính oxi hoá và tính khử.
- Trong môi trường axit, muối crom(III) có tính oxi hoá và dễ bị những chất khử như Zn khử thành muối crom(II):
2 (dd) + → 2 (dd) + (dd)
Trong môi trường kiềm, muối crom(III) có tính khử và bị những chất oxi hóa mạnh oxi hóa thành muối crom(VI):
2 (dd) + + 16OH-→ 2 (dd) + (dd) + 8H2O
III. HỢP CHẤT Crom (VI)
1. Crom (VI) oxit, CrO3
- CrO3 là chất rắn, màu đỏ thẫm, là oxit axit có tính OXH rất mạnh.
- Một số chất vô cơ và hữu cơ như S, P, C, NH3, C2H5OH,... bốc cháy khi tiếp xúc với CrO3, đồng thời CrO3 bị khử thành Cr2O3. Ví dụ :
2CrO3 + 2NH3 → Cr2O3 + N2 + 3H2O
- CrO3 là một oxit axit, tác dụng với nước tạo thành hỗn hợp axit cromic H2CrO4 và axit đicromic H2Cr2O7 :
CrO3 + H2O → H2CrO4
2CrO3 + H2O → H2Cr2O7
=> Hai axit này không tách ra được ở dạng tự do, chỉ tồn tại trong dung dịch. Nếu tách khỏi dung dịch, chúng sẽ bị phân huỷ trở lại thành CrO3.
2. Muối cromat và dicrommat.
- Muối cromat là muối có chứa ion: CrO42- (màu vàng)
- Muối dicromat là muối có chứa ion: Cr2O72- (màu da cam)
- Trong môi trường thích hợp, các muối cromat và đicromat chuyển hóa lẫn nhau theo một cân bằng :
2 + 2H+ + H2O
(màu vàng) (màu da cam)
* Tính OXH mạnh khi tác dụng với chất có tính khử:
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 +7H2O
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O
Dạng 1
Lý thuyết về crom và hợp chất của crom
|
* Một số lưu ý cần nhớ: - Crom là một kim loại có mức độ hoạt động hóa học nằm giữa Zn và Fe - Crom không tác dụng với NaOH ở mọi điều kiện và bị thụ động trong HNO3 đặc nguội, H2SO4 đặc nguội. - Crom có thể tác dụng được với: phi kim, dung dịch axit (HCl, H2SO4, HNO3 ..) , dung dịch muối - CrO là oxit bazo, Cr2O3 là oxit lưỡng tính, CrO3 là oxit axit 2 + 2H+ + H2O (màu vàng) (màu da cam) |
* Một số ví dụ điển hình:
Ví dụ 1: Crom không phản ứng với chất nào sau đây ?
A. dung dịch H2SO4 loãng đun nóng.
B. dung dịch NaOH đặc, đun nóng.
C. dung dịch HNO3 đặc, đun nóng.
D. dung dịch H2SO4 đặc, đun nóng.
Hướng dẫn giải chi tiết:
Crom không tác dụng với dung dịch NaOH ở mọi điều kiện
Đáp án B
Ví dụ 2: Al và Cr giống nhau ở điểm :
A. cùng tác dụng với HCl tạo ra muối có mức oxi hóa là +3.
B. cùng tác dụng với dung dịch NaOH dư tạo ra chất Na[M(OH)4].
C. cùng tác dụng với khí clo tạo ra muối có dạng MCl3.
D. cùng bị thụ động trong dung dịch nước cường toan.
Hướng dẫn giải chi tiết:
A. cùng tác dụng với HCl tạo ra muối có mức oxi hóa là +3. (Crom tác dụng với HCl có mức OXH là +2)
B. cùng tác dụng với dung dịch NaOH dư tạo ra chất Na[M(OH)4]. (Crom không tác dụng với NaOH ở mọi điều kiện)
C. cùng tác dụng với khí clo tạo ra muối có dạng MCl3. (đúng)
D. cùng bị thụ động trong dung dịch nước cường toan. (sai, đều phản ứng trong dung dịch nước cường toan)
Đáp án C.
Ví dụ 3: Cho sơ đồ chuyển hoá giữa các hợp chất của crom :
Cr(OH)3.. X Y Z T
Các chất X, Y, Z, T theo thứ tự là :
A. KCrO2 ; K2CrO4 ; K2Cr2O7 ; Cr2(SO4)3.
B. K2CrO4 ; KCrO2 ; K2Cr2O7 ; Cr2(SO4)3.
C. KCrO2 ; K2Cr2O7 ; K2CrO4 ; CrSO4.
D. KCrO2 ; K2Cr2O7 ; K2CrO4 ; Cr2(SO4)3.
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
Cr(OH)3 + KOH → KCrO2 + 2H2O
2KCrO2 + 3Cl2 + 8KOH → 2K2CrO4 + 6KCl + 4H2O
K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4
K2Cr2O7 + FeSO4 + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + H2O
Đáp án A
Dạng 2
Crom tác dụng với phi kim và dung dịch axit
|
* Một số lưu ý cần nhớ - Crom bị thụ động trong H2SO4 đặc, nguội và HNO3 đặc nguội. - Crom tan được trong dung dịch HCl loãng, nóng; H2SO4 loãng nóng. |
* Một số ví dụ điển hình:
Ví dụ 1: Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí) thu được dung dịch X và 7,84 lít khí H2 (đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) thu được m gam muối khan. Giá trị của m là
Hướng dẫn giải chi tiết:
Định luật bảo toàn nguyên tử:
Bảo toàn khối lượng:
Ta có: mMuối = 13,5 + 34,3 – 0,7 = 47,1 (gam)
Ví dụ 2: Hòa tan hết 2,16 gam hỗn hợp Cr và Fe trong dung dịch HCl (loãng), nóng thu được 896 ml khí (đktc). Lượng crom có trong hỗn hợp là :
A. 0,065 gam.
B. 1,04 gam.
C. 0,560 gam.
D. 1,015 gam.
Hướng dẫn giải chi tiết:
n H2 = 0,896 : 22,4 = 0,04 (mol)
Gọi số mol của Cr, Fe có trong hỗn hợp trên lần lượt là x, y (mol)
Tổng khối lượng kim loại có được trong dung dịch sau phản ứng là 2,16 gam
=> 52x + 56y = 2,16 (I)
Áp dụng định luật bảo toàn electron
2 . n Cr + 2 . n Fe = 2 . 0,04
=> 2x + 2y = 0,08 (II)
Từ (I) và (II)
=> x = 0,02; y = 0,02
=> m Cr = 0,02 .52 = 1,04 gam
Đáp án B
Ví dụ 3: Đốt cháy hoàn toàn bột crom trong oxi (dư) thu được 4,56 gam một oxit (duy nhất). Khối lượng crom bị đốt cháy là :
A. 0,78 gam.
B. 3,12 gam.
C. 1,74 gam.
D. 1,19 gam.
Hướng dẫn giải chi tiết:
Ta có phương trình hóa học:
2Cr + 3O2 → 2Cr2O3
n Cr2O3 = 4,56 : 152 = 0,03 mol
n Cr = 2 n Cr2O3 = 0,06 mol
=> m Crom = 0,06 . 52 = 3,12 gam
Đáp án B
Dạng 3
Bài toán về phản ứng nhiệt nhôm của oxit crom
|
* Một số lưu ý cần nhớ: Ta có phản ứng nhiệt nhôm của Al với oxit của crom như sau: 2Al + Cr2O3 → Al2O3 + 2Cr Đối với dạng câu hỏi này, các em thường áp dụng định luật bảo toàn electron, bảo toàn nguyên tố để giải quyết bài toán. |
Ví dụ 1: Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng). Để hòa tan hết phần hai cần vừa đủ dung dịch chứa a mol HCl. Giá trị của a là
Hướng dẫn giải chi tiết:
TH1: Al dư, Cr2O3 hết. Chỉ có Al dư và Al2O3 tan trong NaOH => nAl ban đầu = nNaOH = 0,3 mol
=> nCr2O3 = 0,1
Với HCl, sản phẩm chứa Al3+ (0,3 mol), Cr2+ (0,2 mol) => nCl- = 1,3 mol
Vậy nHCl = 1,3 mol
TH2: Al hết (x mol), Cr2O3 còn dư (y mol)
=> nNaOH = x + 2y = 0,3
mhh = 27x + 152.(0,5x + y) = 23,3
=> x = 1/54 và y = 19/135
Với HCl, sản phẩm chứa Al3+ (1/54 mol), Cr3+ (2y = 38/135) và Cr2+ (1/54 mol)
=> nCl- = 0,937 mol
Ví dụ 2: Khối lượng bột nhôm cần dùng để điều chế được 3,9 gam crom bằng phương pháp nhiệt nhôm là :
A. 20,250 gam.
B. 35,696 gam.
C. 2,025 gam.
D. 81,000 gam.
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
2Al + Cr2O3 → Al2O3 + 2Cr
=> n Cr = 3,9 : 52 = 0,075 mol
Từ phương trình: n Al = n Cr = 0,075 mol
m Al = 0,075 . 27 = 2,025 gam
Đáp án C.

