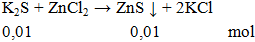Chúng tôi xin giới thiệu phương trình K2S + ZnCl2 → ZnS ↓ + 2KCl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình K2S + ZnCl2 → ZnS ↓ + 2KCl
1. Phương trình phản ứng hóa học:
K2S + ZnCl2 → ZnS ↓ + 2KCl
2. Hiện tượng nhận biết phản ứng
- thu được kết tủa màu trắng.
3. Điều kiện phản ứng
- điều kiện thường.
4. Tính chất hóa học
- Chất này có thể điều chế bằng cách đun nóng K2SO4 với carbon (than cốc):
- K2SO4 + 4C → K2S + 4CO↑
Trong phòng thí nghiệm K2S nguyên chất có thể điều chế bằng cách cho kali hóa hợp với lưu huỳnh trong môi trường amonia khan.
- Muối sulfide là muối rất cơ bản, do vậy K2S hoàn toàn thủy phân trong nước theo phản ứng sau đây:
- K2S + H2O → KOH + KHS
Đối với nhiều mục đích, phản ứng này không quan trọng vì hỗn hợp của HS− và OH− phản ứng như dung dịch S2−. Các muối sulfide của kim loại kiềm khác (trừ Na) cũng có tính chất tương tự.
5. Cách thực hiện phản ứng
- nhỏ dung dịch K2S vào ống nghiệm chứa ZnCl2
6. Bạn có biết
- Các dung dịch muối kẽm có thể phản ứng với K2S để thu được kết tủa.
7. Bài tập liên quan
Ví dụ 1: Nhỏ K2S vào ống nghiệm chứa ZnCl2 thu được hiện tượng là
A. Có kết tủa đen.
B. Có kết tủa trắng.
C. Có khí mùi trứng thối thoát ra.
D. Không có hiên tượng gì.
Hướng dẫn giải
K2S + ZnCl2 → ZnS ↓ + 2KCl
ZnS: kết tủa trắng.
Đáp án B.
Ví dụ 2: Chất nào sau đây có màu trắng?
A. CuS.
B. MnS.
C. SnS.
D. ZnS.
Hướng dẫn giải
ZnS có màu trắng.
Đáp án D.
Ví dụ 3: Khối lượng kết tủa thu được khi cho ZnCl2 phản ứng hoàn toàn với 0,01 mol K2S là
A. 0,97g.
B. 2,44g.
C. 0,88g.
D. 3,02g.
Hướng dẫn giải
Khối lượng kết tủa = 0,01. 97 = 0,97 gam.
Đáp án A.
7. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
K2S + Zn(NO3)2 → ZnS ↓ + 2KNO3
K2S + Pb(NO3)2 → PbS ↓ + 2KNO3
K2S + Cu(NO3)2 → CuS ↓ + 2KNO3
K2SO3 + 2HCl → 2KCl + SO2 + H2O
K2SO3 + 2HBr → 2KBr + SO2 + H2O