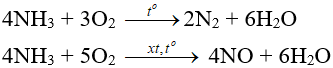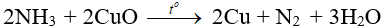Chúng tôi xin giới thiệu phương trình AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
1. Phương trình phản ứng hóa học:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
2. Hiện tượng nhận biết phản ứng
- Tạo kết tủa keo trắng Al(OH)3, nếu dung dịch NaOH dư thì kết tủa keo trắng bị hoà tan dần dần cho đến hết.
Al(OH)3 + NaOH → NaAlO2 + 2H2O
3. Điều kiện phản ứng
- Điều kiện thường.
4. Tính chất hoá học
4.1. Tính chất hoá học của AlCl3
- Mang đầy đủ tính chất hóa học của muối
- Tác dụng với dung dịch bazo:
AlCl3 + NaOH(vừa đủ) → NaCl + Al(OH)3
- Tác dụng với dung dịch muối khác:
AlCl3 + AgNO3 → AgCl↓ + NaNO3
- Phản ứng với kim loại mạnh hơn:
3Mg + 2AlCl3 → 3MgCl2 + 2Al
4.2. Tính chất hoá học của NH3
Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
4.3. Tính chất hóa học của H2O
- Nước tác dụng với kim loại
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
- Nước tác dụng với oxit bazo
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịc bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
- Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
5. Cách thực hiện phản ứng
- Sục từ từ khí NH3 vào dung dịch AlCl3 tạo kết tủa keo trắng dần dần đến không đổi.
6. Bạn có biết
- Các muối của kim loại hoạt động trung bình khi phản ứng với dung dịch NH3 đều tạo kết tủa hidroxit.
7. Bài tập liên quan
Ví dụ 1: Viết phương trình rút gọn của phản ứng sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
A. Al3+ + 2NH3 + 3H2O → Al(OH)3 + 2NH4+
B. Al3+ + 2NH3 + 3H2O → Al(OH)3 + 2NH4+
C. Al3+ + 2NH3 → Al(OH)3 + 2NH4+
D. Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
Hướng dẫn giải
Chọn D.
NH3, H2O, Al(OH)3 điện ly yếu không chuyển sang dạng ion.
Ví dụ 2:Cho các TN sau: (1). Sục khí CO2 vào dung dịch natri aluminat. (2). Cho dd NH3 dư vào dung dịch AlCl3. (3). Dung dịch NaOH dư vào dung dịch AlCl3. (4). Dung dịch NaOH dư vào dung dịch Ba(HCO3)2. Những trường hợp thu được kết tủa sau phản ứng là:
A. (1), (2), (3)
B. (2), (3), (4)
C. (2), (3), (4)
D. (1), (2), (4)
Hướng dẫn giải
Chọn D.
(1). Sục khí CO2 vào dd natri aluminat:
2H2O + NaAlO2 + CO2 → Al(OH)3↓ + NaHCO3
(2). Cho dd NH3 dư vào dd AlCl3:
AlCl3 + 3H2O + 3NH3 → Al(OH)3↓ + 3NH4Cl
(3). Dung dịch NaOH dư vào dd AlCl3. Không có kết tủa vì bị tan:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
(4). Dung dịch NaOH dư vào dd Ba(HCO3)2.
2NaOH + Ba(HCO3)2 → 2H2O + Na2CO3 + BaCO3 ↓
Ví dụ 3:Hiện tượng thí nghiệm khi thực hiện thí nghiệm sục từ từ khí NH3 vào dung dịch AlCl3 là gì?
A. Kết tủa keo trắng xuất hiện, sau đó kết tủa tan dần.
B. Kết tủa keo trắng xuất hiện tăng dần đến max.
C. Dung dịch chuyển màu xanh.
D. Không có hiện tượng gì xảy ra.
Hướng dẫn giải
Chọn B.
AlCl3 + 3H2O + 3NH3 → Al(OH)3↓ + 3NH4Cl
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
AlCl3 + 3NH4OH → Al(OH)3↓ + 3NH4Cl
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2↑
2AlCl3 + 6H2O + 2Na2S → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
AlCl3 + 3AgNO3 → 3AgCl↓ + Al(NO3)3