Chúng tôi giới thiệu Giải bài tập Hóa học lớp 12 Bài 35: Đồng và hợp chất của đồng chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Đồng và hợp chất của đồng lớp 12.
Bài giảng Hóa học 12 Bài 35: Đồng và hợp chất của đồng
Giải bài tập Hóa học 12 Bài 35: Đồng và hợp chất của đồng
Câu hỏi và bài tập (trang 158,159 SGK Hóa Học 12)
Bài 1 trang 158 SGK Hóa Học 12: Cấu hình electron của Cu2+ là :
A. [Ar]3d7. B. [Ar]3d8.
C. [Ar]3d9. D. [Ar]3d10.
Lời giải:
Cấu hình electron của Cu (Z =29): [Ar]3d104s1
=> Công thức cấu tạo của Cu2+ là: [Ar]3d9
Đáp án C
Bài 2 trang 159 SGK Hóa Học 12: Cho 19,2 gam kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 4,48 lít khí duy nhất NO(đktc). Kim loại M là :
A.Mg B.Cu.
C.Fe. D.Zn.
Lời giải:
Cách 1:
Ta có
3M + 4HNO3 → 3M(NO3)n+ nNO + 2H2O.
=>MM = m : n = 19,2 : 0,6/n = 32n ⟹ Chỉ có n = 2 thì MM = 64. Vậy M là Cu.
Đáp án B
Cách 2:
M – ne → M+n N+5 +3e → NO
← 0,6 0,6←0,2
Cho n chạy các giá trị 1,2,3 thì thấy n = 2 => M = 64 (Cu) (thỏa mãn)
Đáp án B
Bài 3 trang 159 SGK Hóa Học 12: Cho 7,68 gam Cu tác dụng hết với dung dịch HNO3 loãng thấy có khí NO thoát ra. Khối lượng muối nitrat sinh ra trong dung dịch là :
A.21,56 gam. B. 21,65 gam.
C. 22,56 gam. D. 22,65 gam.
Phương pháp giải:
Bảo toàn nguyên tố Cu
nCu(NO3)2 = nCu = 0,12 (mol)
=> nCu(NO3)2 = ?
Lời giải:
Bảo toàn nguyên tố Cu
nCu(NO3)2 = nCu = 0,12 (mol)
=> nCu(NO3)2 = 0,12.188 = 22,56 (g)
Đáp án C
Bài 4 trang 159 SGK Hóa Học 12: Đốt 12,8 gam Cu trong không khí, hòa tan chất rắn thu được trong dung dịch HNO3 0,5M thấy thoát ra 448ml khí NO duy nhất (đktc).
a)Viết phương trình phản ứng hóa học xảy ra.
b)Tính thể tích tối thiểu dung dịch HNO3 cần dùng để hòa tan chất rắn.
Phương pháp giải:
a) Viết PTHH xảy ra
2Cu + O2 → 2CuO
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
b) Tính toán theo PTHH
Lời giải:
a)
2Cu + O2 → 2CuO (1)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2)
CuO + 2HNO3 → Cu(NO3)2 + H2O (3)
b)
nCu = 0,2 (mol) ; nNO = 0,02 (mol)
Từ (2) => nCu(dư) = nNO = 0,03 (mol) ;
nHNO3(2) = 4nNO = 4.0,02 = 0,08 (mol)
Từ (1) => nCuO = nCu(phản ứng) = 0,2 - 0,03 = 0,17 (mol).
Từ (3) => nHNO3 (3) = 2nCuO = 2. 0,17 = 0,34 (mol)
Vậy thể tích dung dịch HNO3 cần dùng là : (lít).
Bài 5 trang 159 SGK Hóa Học 12: Hòa tan 58 gam muối CuSO4.5H2O vào nước được 500 ml dung dịch A.
a) Xác định nồng độ mol của dung dịch A.
b) Cho dần dần bột sắt vào 50 ml dung dịch A, khuấy nhẹ cho tới khi dung dịch hết màu xanh. Tính lượng sắt đã tham gia phản ứng.
Phương pháp giải:
a) Công thức tính nồng độ mol CM = n : V
b) Cho Fe vào đến khi dung dịch hết màu xanh => phản ứng xảy ra hoàn toàn
PTHH: Fe + CuSO4 → FeSO4 + Cu↓
Tính số mol Fe theo số mol CuSO4
Lời giải:
a) (mol).
=>CMCuSO4 = n : V
= 0,232 : 0,5
= 0,464 (M)
b) Fe + CuSO4 → FeSO4 + Cu
0,0232 (mol).
=> mFe = 0,0232.56 = 1,2992 gam.
Chú ý: Đề bài chỉ cho vào 50 ml dung dịch A
Bài 6 trang 159 SGK Hóa Học 12: Một thanh đồng có khối lượng 140,8 gam được ngâm trong dung dịch AgNO3 nồng độ 32% (D = 1,2 g/ml) đến phản ứng hoàn toàn. Khi lấy thanh đồng ra thì nó có khối lượng là 171,2 gam. Tính thể tích dung dịch AgNO3 đã dùng để ngâm thanh đồng (giả thiết toàn bộ lượng Ag tạo ra bám hết vào thanh đồng).
Phương pháp giải:
Gọi số mol của Cu phản ứng là x (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
x → 2x (mol)
Dùng phương pháp tăng giảm khối lượng ta có:
∆mtăng = mAg – mCu pư
=> (171,2 - 140,8) = 2x.108 - 64x
=> x =?
=> nAgNO3
Lời giải:
Gọi số mol của Cu phản ứng là x (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
x → 2x → 2x (mol)
Dùng phương pháp tăng giảm khối lượng ta có:
∆mtăng = mAg – mCu pư
=> (171,2 - 140,8) = 2x.108 - 64x
=>152x = 30,4
=> x = 0,2 (mol)
=> nAgNO3 = 0,4 (mol)
Khối lượng AgNO3 là 0,4.170 = 68 gam
A. ĐỒNG
I. VỊ TRÍ VÀ CẤU TẠO
- Đồng thuộc nhóm IB, có chu kì 4, có số hiệu nguyên tử là 29.
- Cấu hình electron nguyên tử của Cu : [Ar] 3d104s1 ; Cu+ : [Ar] 3d10 ; Cu2+ :[Ar] 3d9 .
II. TÍNH CHẤT VẬT LÍ
Là kim loại màu nâu đỏ, khối lượng riêng lớn, dẻo, dễ kéo sợi và dát mỏng, dẫn điện, dẫn nhiệt tốt (chỉ kém hơn bạc).
III. TÍNH CHẤT HÓA HỌC
Tác dụng với phi kim
- Khi đốt nóng:
2Cu + O2 2CuO
Cu tác dụng với Cl2, Br2, S, ... ở nhiệt độ thường hoặc đun nóng:
Cu + Cl2 → CuCl2 (đồng clorua)
B. MỘT SỐ HỢP CHẤT CỦA ĐỒNG
I. ĐỒNG (II) OXIT
- CuO: là chất rắn màu đen, không tan trong nước
- Là oxit bazơ; dễ bị CO, C, H2 khử thành Cu kim loại
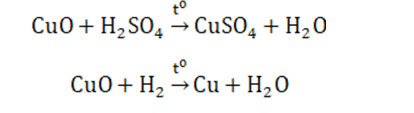
Điều chế bằng cách nhiệt phân Cu(OH)2, Cu(NO3)2, CuCO3,…
II. ĐỒNG (II) HIDROXIT
- Cu(OH)2 : là chất rắn màu xanh
- Có tính bazơ, không tan trong nước nhưng tan dễ trong dung dịch axit
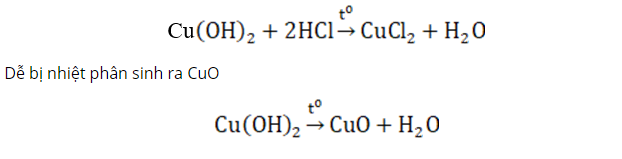
Điều chế từ dung dịch muối đồng (II) và dung dịch bazơ.
III. MUỐI ĐỒNG (II)
- CuSO4dạng khan là chất rắn màu trắng, trạng muối hiđrat CuSO4.5H2O có màu xanh.
- Ứng dụng:
+ Trên 50% sản lượng dùng làm dây dẫn điện và trên 30% dùng làm hợp kim; hợp kim của đồng như đồng thau (Cu – Zn) ; đồng bạch (Cu–Ni) ; đồng thanh (Cu – Sn) ;… có rất nhiều ứng dụng trong công nghiệp và đời sống như: chế tạo chi tiết máy, thiết bị dùng trong công nghiệp đóng tàu biển
+ CuSO4 dùng trong nông nghiệp để chữa mốc sương cho cà chua, khoai tây; ở dạng khan thì dùng để phát hiện vết nước trong các chất lỏng

