Công thức không mô tả phương trình trạng thái của khí lí tưởng là:
Phương trình trạng thái của khí lý tưởng: \(\frac{{pV}}{T} = const\)
hay \(\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}}\) , \(pV \sim T\)
Đối với một khối khí lý tưởng nhất định, khi áp suất tăng 3 lần và thể tích giảm 2 lần thì nhiệt độ tuyệt đối sẽ:
Từ phương trình trạng thái của khí lý tưởng ta có: \(pV \sim T\)
=> Khi áp suất tăng 3 lần và thể tích giảm 2 lần thì nhiệt độ tuyệt đối sẽ tăng thêm \(\dfrac{3}{2} = 1,5\) lần
Không khí ở áp suất \({10^5}Pa\), nhiệt độ \({0^0}C\) có khối lượng riêng \(1,29kg/{m^3}\). Khối lượng riêng của không khí ở áp suất \({2.10^5}Pa\), nhiệt độ \({100^0}C\) là:
Ta có:
- Trạng thái 1: \(\left\{ \begin{array}{l}{T_1} = 0 + 273 = 273K\\{p_1} = {10^5}Pa\\{V_1} = \frac{m}{{{D_1}}}\end{array} \right.\)
- Trạng thái 2: \(\left\{ \begin{array}{l}{T_2} = 100 + 273 = 373K\\{p_2} = {2.10^5}Pa\\{V_2} = \frac{m}{{{D_2}}}\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
\(\begin{array}{l}\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}} \leftrightarrow \frac{{{p_1}\frac{m}{{{D_1}}}}}{{{T_1}}} = \frac{{{p_2}\frac{m}{{{D_2}}}}}{{{T_2}}}\\{D_2} = \frac{{{p_2}{T_1}{D_1}}}{{{p_1}{T_2}}} = \frac{{{{2.10}^5}.273.1,29}}{{{{10}^5}.373}} = 1,89kg/{m^3}\end{array}\)
Nhiệt độ ban đầu của một khối khí xác định có giá trị là bao nhiêu? Biết rằng khi nhiệt độ tăng thêm \({16^0}C\) thì thể tích khí giảm đi \(10\% \) so với thể tích ban đầu, áp suất thì tăng thêm \(20\% \) so với áp suất ban đầu.
Ta có:
- Trạng thái 1: \({p_1};{V_1};{T_1}\)
- Trạng thái 2: \(\left\{ \begin{array}{l}{p_2} = {p_1} + 0,2{p_1} = 1,2{p_1}\\{V_2} = {V_1} - 0,1{V_1} = 0,9{V_1}\\{T_2} = {T_1} + 16\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
\(\begin{array}{l}\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}} \leftrightarrow \frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{1,2{p_1}.0,9{V_1}}}{{{T_1} + 16}}\\ \to {T_1} = 200K\end{array}\)
Một bình thủy tinh hình trụ tiết diện \(100c{m^2}\) chứa khí lí tưởng bị chặn với tấm chắn có khối lượng không đáng kể, áp suất, nhiệt độ, chiều cao của cột không khí bên trong bình lần lượt là \(76cmHg\), \({20^0}C\) và \(60cm\). Đặt lên tấm chắn vật có trọng lượng \(408N\), cột khí bên trong bình có chiều cao \(50cm\). Nhiệt độ của khí bên trong bình là:
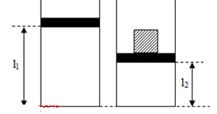
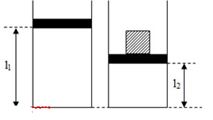
Ta có:
- Trạng thái 1: \(\left\{ \begin{array}{l}{T_1} = 20 + 273 = 293K\\{p_1} = 1,{013.10^5}Pa\\{V_1} = {l_1}S\end{array} \right.\)
- Trạng thái 2: \(\left\{ \begin{array}{l}{T_2} = ?\\{p_2} = {p_1} + \frac{F}{S} = 1,{013.10^5} + \frac{{408}}{{{{100.10}^{ - 4}}}} = 1,{421.10^5}Pa\\{V_2} = {l_2}S\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
\(\begin{array}{l}\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}} \leftrightarrow \frac{{{p_1}.{l_1}S}}{{{T_1}}} = \frac{{{p_2}.{l_2}S}}{{{T_2}}}\\{T_2} = \frac{{{p_2}{l_2}{T_1}}}{{{p_1}{l_1}}} = \frac{{1,{{421.10}^5}.50.293}}{{1,{{013.10}^5}.60}} = 342,5K\end{array}\)
Khí cầu có dung tích \(328{m^3}\) được bơm khí hiđro. Khi bơm xong, hiđro trong khí cầu có nhiệt độ \({27^0}C\), áp suất \(0,9{\rm{a}}tm\). Ta phải bơm bao lâu nếu mỗi giây bơm được \(2,5g\) hiđro vào khí cầu?
Ta có:
- Thể tích: \(V = 328{m^3} = {328.10^3}l\)
- Nhiệt độ: \(T = 27 + 273 = 300K\)
- Áp suất: \(p = 0,9{\rm{a}}tm\)
Gọi m là khối khí đã bơm vào khí cầu, áp dụng phương trình Cla-pe-rôn - Men-đê-lê-ép, ta có:
\(pV = \frac{m}{M}RT \to m = M\frac{{pV}}{{RT}} = 2.\frac{{0,{{9.328.10}^3}}}{{0,082.300}} = 24000g\)
Biết mỗi giây bơm được \(2,5g\) hiđrô vào khí cầu
=> Thời gian để bơm được \(m\left( g \right)\) hiđrô vào khí cầu là: \(t = \frac{m}{{2,5}} = \frac{{24000}}{{2,5}} = 9600{\rm{s}} = 160phut\)
Thể tích của \(10g\) khí ôxi ở áp suất \(738mmHg\) và nhiệt độ \({15^0}C\) là:
Đổi đơn vị: \(738mmHg = 0,{984.10^5}Pa\)
Nhiệt độ: \(T = 15 + 273 = 288K\)
Áp dụng phương trình Cla-pe-rôn - Men-đê-lê-ép, ta có:
\(\begin{array}{l}pV = n{\rm{R}}T = \frac{m}{M}RT\\ \to V = \frac{m}{M}\frac{{RT}}{p} = \frac{{10}}{{32}}\frac{{0,082.288}}{{0,984}} = 7,5l\end{array}\)
Bình chứa được \(4g\) hiđrô ở \({53^0}C\) dưới áp suất \(44,{4.10^5}N/{m^2}\). Thay Hiđrô bởi khí khác thì bình chứa được \(8g\) khí mới ở \({27^0}C\) dưới áp suất \({5.10^5}pa\). Khí thay Hiđro là khí gì? Biết khí này là đơn chất.
- Khi khí trong bình là Hiđrô: \(\left\{ \begin{array}{l}{m_1} = 4g\\{T_1} = 53 + 273 = 326K\\{p_1} = 44,{4.10^5}Pa\\{M_1} = 2\end{array} \right.\)
- Khi thay khí trong bình bằng khí X: \(\left\{ \begin{array}{l}{m_2} = 8g\\{T_2} = 27 + 273 = 300K\\{p_2} = {5.10^5}Pa\\{M_2} = ?\end{array} \right.\)
Ta có thể tích bình chứa không thay đổi, viết phương trình Cla-pe-rôn - Men-đê-lê-ép cho hai trường hợp ta có:
\(\begin{array}{l}{V_1} = \frac{{{m_1}}}{{{M_1}}}\frac{{R{T_1}}}{{{p_1}}}{\rm{ }}\left( 1 \right)\\{V_2} = \frac{{{m_2}}}{{{M_2}}}\frac{{R{T_2}}}{{{p_2}}}{\rm{ }}\left( 2 \right)\end{array}\)
Ta có:
\(\begin{array}{l}{V_1} = {V_2} \leftrightarrow \frac{{{m_1}}}{{{M_1}}}\frac{{R{T_1}}}{{{p_1}}} = \frac{{{m_2}}}{{{M_2}}}\frac{{R{T_2}}}{{{p_2}}}\\ \leftrightarrow \frac{4}{2}\frac{{326}}{{44,{{4.10}^5}}} = \frac{8}{{{M_2}}}\frac{{300}}{{{{5.10}^5}}}\\ \to {M_2} \approx 32\end{array}\)
=> Chất khí được thay là \({O_2}\)có \(M = 32\)
Một bình chứa \(0,3kg\) Heli. Sau một thời gian do bị hở, khí Heli thoát ra một phần. Nhiệt độ tuyệt đối của khí giảm tới \(10\% \), áp suất giảm \(20\% \). Khối lượng Heli đã thoát ra khỏi bình là:
Ta có:
- Ban đầu, khí Heli có khối lượng \(m\), thể tích \(V\), áp suất \(p\), nhiệt độ \({T_1}\)
PT: \({p_1}V = \frac{m}{M}R{T_1}{\rm{ }}\left( 1 \right)\)
- Sau một thời gian, khí Heli có khối lượng \(m'\), thể tích \(V\), áp suất \({p_2}\), nhiệt độ \({T_2}\)
PT: \({p_2}V = \frac{{m'}}{M}R{T_2}{\rm{ }}\left( 2 \right)\)
Lấy \(\frac{{\left( 2 \right)}}{{\left( 1 \right)}}\) ta được:
\(\frac{{{p_2}}}{{{p_1}}} = \frac{{m'}}{m}\frac{{{T_2}}}{{{T_1}}}\)
Trừ cả hai vế cho 1, ta đươc:
\(\begin{array}{l}\frac{{{p_2}}}{{{p_1}}} - 1 = \frac{{m'}}{m}\frac{{{T_2}}}{{{T_1}}} - 1\\ \leftrightarrow \frac{{{p_2} - {p_1}}}{{{p_1}}} = \frac{{m'{T_2} - m{T_1}}}{{m{T_1}}} = \frac{{m'\left( {{T_2} + \Delta T} \right) - m{T_1}}}{{m{T_1}}}\\ \leftrightarrow \frac{{\Delta p}}{{{p_1}}} = \frac{{m' - m}}{m} + \frac{{m'}}{m}\frac{{\Delta T}}{{{T_1}}}{\rm{ }}\left( 3 \right)\end{array}\)
Mặt khác, theo đề bài, ta có: \(\left\{ \begin{array}{l}\frac{{\Delta p}}{{{p_1}}} = - 0,2\\\frac{{\Delta T}}{{{T_1}}} = - 0,1\end{array} \right.\)
Thế vào (3), ta được:
\(\begin{array}{l} - 0,2 = \frac{{m' - m}}{m} + \frac{{m'}}{m}\left( { - 0,1} \right)\\ \leftrightarrow m' - m - 0,1m' = - 0,2m\\ \leftrightarrow 0,9m' = 0,8m\\ \to m' = \frac{8}{9}m\end{array}\)
=> Lượng khí Heli đã thoát ra:
\(\Delta m = m - m' = m - \frac{8}{9}m = \frac{m}{9} = \frac{{0,3}}{9} = 0,03333kg = 33,33g\)
Hai bình có dung tích bằng nhau chứa cùng một loại khí. Khối lượng của khí lần lượt là m và m’. Ta có đồ thị như sau:
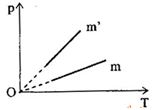
Nhận xét nào sau đây là đúng?
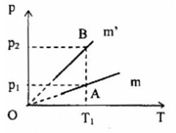
Vẽ đường thẳng qua \({T_1}\) song song với trục \(Op\), cắt đồ thị \(\left( {p,T} \right)\) của hai khí tại: \(A\left( {{p_1},{V_1},{T_1}} \right)\) và \(B\left( {{p_2},{V_1},{T_1}} \right)\)
Viết phương trình Cla-pe-rôn - Men-đê-lê-ép cho hai trạng thái, ta được:
\(\left\{ \begin{array}{l}{p_1}{V_1} = \frac{m}{M}R{T_1}{\rm{ }}\left( 1 \right)\\{p_2}{V_1} = \frac{{m'}}{M}R{T_1}{\rm{ }}\left( 2 \right)\end{array} \right.\)
Từ (1) và (2), ta suy ra: \(\frac{{m'}}{m} = \frac{{{p_2}}}{{{p_1}}}\)
Mặt khác, từ đồ thị, ta thấy: \({p_2} > {p_1}\) ta suy ra \(m' > m\)
Một lượng khí biến đổi theo chu trình biểu diễn bởi đồ thị. Cho biết \({p_1} = {p_3}\), \({V_1} = 1{m^3}\), \({V_2} = 4{m^3}\), \({T_1} = 100K,{T_4} = 300K\). \({V_3} = ?\)
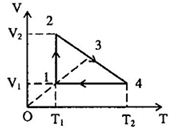
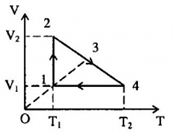
- Quá trình \(\left( 1 \right) \to \left( 2 \right)\): đẳng nhiệt \({T_2} = {T_1} = 100K,{V_2} = 4{m^3}\)
- Quá trình \(\left( 4 \right) \to \left( 1 \right)\): đẳng tích \({V_4} = {V_1} = 1{m^3};{T_4} = 300K\)
- Quá trình \(\left( 2 \right) \to \left( 4 \right)\): \(V = aT + b\)
+ Trạng thái \(\left( 2 \right)\): \(4 = 100{\rm{a}} + b\) (1')
+ Trạng thái \(\left( 4 \right)\): \(1 = 300{\rm{a}} + b\) (2')
Từ \(\left( 1' \right)\) và \(\left( 2' \right)\) suy ra: \(\left\{ \begin{array}{l}a = - \frac{3}{{200}} = - 1,5\\b = 5,5\end{array} \right.\)
Ta suy ra: \(V = - \frac{3}{{200}}T + 5,5\)
- Quá trình \(\left( 1 \right) \to \left( 3 \right)\): đẳng áp \(V = \frac{{{V_1}}}{{{T_1}}}T = \frac{1}{{100}}T{\rm{ }}\left( 4 \right)\)
Vì \(\left( 3 \right)\) là giao điểm của hai đường \(\left( 2 \right) - \left( 4 \right)\) và \(\left( 1 \right) - \left( 3 \right)\) nên:
\(\begin{array}{l} - \frac{3}{{200}}{T_3} + 5,5 = \frac{1}{{100}}{T_3}\\ \to {T_3} = 220K\end{array}\)
Ta suy ra: \({V_3} = \frac{1}{{100}}.220 = 2,2{m^3}\)
Có \(20g\) khí Heli chứa trong xilanh đậy kín bởi pittong biến đổi chậm từ \(\left( 1 \right) \to \left( 2 \right)\) theo đồ thị như hình vẽ:
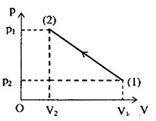
Cho \({V_1} = 30l,{p_1} = 5{\rm{a}}tm\) ; \({V_2} = 10l,{p_2} = 15{\rm{a}}tm\).Tìm nhiệt độ cao nhất mà khí đạt được trong quá trình trên?
Quá trình \(\left( 1 \right) - \left( 2 \right):p = aV + b\)
Thay các giá trị \(\left( {{p_1},{V_1}} \right)\) và \(\left( {{p_2},{V_2}} \right)\) vào \(\left( 1 \right)\) ta được:
\(\left\{ \begin{array}{l}5 = 30{\rm{a}} + b{\rm{ }}\left( 1 \right)\\10 = 10{\rm{a}} + b{\rm{ }}\left( 2 \right)\end{array} \right.\)
Từ\(\left( 1 \right)\) và \(\left( 2 \right)\)suy ra: \(\left\{ \begin{array}{l}a = - \frac{1}{2}\\b = 20\end{array} \right. \to p = - \frac{V}{2} + 20\)
Ta suy ra: \(pV = - \frac{{{V^2}}}{2} + 20V{\rm{ }}\left( 3 \right)\)
Mặt khác: \(pV = \frac{m}{M}RT = \frac{{20}}{4}RT = 5{\rm{R}}T{\rm{ }}\left( 4 \right)\)
Từ \(\left( 4 \right)\), ta suy ra: \(T = - \frac{{{V^2}}}{{10{\rm{R}}}} + \frac{{4V}}{R}{\rm{ }}\left( 5 \right)\)
Xét hàm \(T = f\left( V \right)\) (phương trình số 5), ta có:
\(T = {T_{{\rm{max}}}}\)khi \(V = - \frac{b}{{2{\rm{a}}}} = - \frac{{\frac{4}{R}}}{{2.\frac{{ - 1}}{{10{\rm{R}}}}}} = 20l\)
Khi đó: \({T_{max}} = - \frac{{{{20}^2}}}{{10.0,082}} + \frac{{4.20}}{{0,082}} = 487,8K\)
Một lượng khí đựng trong một xilanh có pittông chuyển động được. Các thông số trạng thái của lượng khí này là: 2,5at, 20lít, 300K. Khi pittông nén khí, áp suất của khí tăng lên tới 5at, thể tích giảm còn 15lít. Nhiệt độ của khí nén là :
Xét lượng khí chứa trong xilanh:
\(TT1:\left\{ \begin{array}{l}{p_1} = 2,5at\\{V_1} = 20l\\{T_1} = 300K\end{array} \right. \to TT2:\left\{ \begin{array}{l}{p_2} = 5at\\{V_2} = 15l\\{T_2} = ?\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lí tưởng ta có:
\(\dfrac{{{p_1}.{V_1}}}{{{T_1}}} = \dfrac{{{p_2}.{V_2}}}{{{T_2}}} \Rightarrow {T_2} = \dfrac{{{p_2}.{V_2}.{T_1}}}{{{p_1}.{V_1}}} = \dfrac{{5.15.300}}{{2,5.20}} = 450K\)
Đồ thị như hình vẽ biểu diễn quá trình biến đổi của 3g khí H2. Biết trạng thái đầu khí có nhiệt độ là 170C. Tính nhiệt độ của khí ở trạng thái cuối?
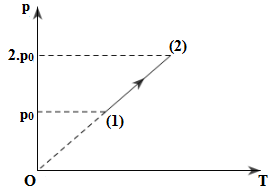

Xét 5g khí H2:
Áp dụng định luật Saclo ta có:
\(\dfrac{{{p_1}}}{{{T_1}}} = \dfrac{{{p_2}}}{{{T_2}}} \Rightarrow {T_2} = \dfrac{{{p_2}{T_1}}}{{{p_1}}} = \dfrac{{2.{p_0}.290}}{{{p_0}}} = 580K \Rightarrow {t_2} = {307^0}C\)
Một lượng không khí chứa trong một quả cầu đàn hồi có thể tích 3 lít, ở nhiệt độ 300C và áp suất 100 kPa. Khi nhúng quả cầu vào nước có nhiệt độ 20C thì áp suất của không khí trong đó là 3.105Pa. Hỏi thể tích của quả cầu đó giảm đi bao nhiêu ?
Xét lượng khí chứa trong quả cầu:
\(TT1:\left\{ \begin{array}{l}{V_1} = 3l\\{T_1} = 30 + 273 = 303K\\{p_1} = {100.10^3} = {10^5}\left( {Pa} \right)\end{array} \right. \to TT2:\left\{ \begin{array}{l}{V_2} = ?\\{T_2} = 2 + 273 = 275K\\{p_2} = {3.10^5}\left( {Pa} \right)\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lí tưởng ta có:
\(\dfrac{{{p_1}{V_1}}}{{{T_1}}} = \dfrac{{{p_2}{V_2}}}{{{T_2}}} \Rightarrow {V_2} = \dfrac{{{p_1}{V_1}.{T_2}}}{{{p_2}{T_1}}} = \dfrac{{{{10}^5}.3.275}}{{{{3.10}^5}.303}} = 0,91l\)
→ Thể tích quả cầu giảm đi: \(\Delta V = {V_1} - {V_2} = 3 - 0,91 = 2,09l\)
Một khối khí thay đổi trạng thái như đồ thị biểu diễn. Sự biến đổi khí trên trải qua hai quá trình là nung nóng
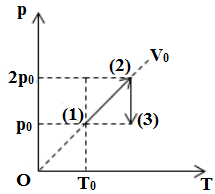
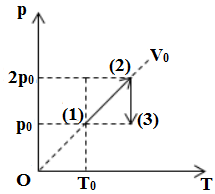
+ Từ \(T{T_1} \to T{T_2}\): quá trình đẳng tích
+ Từ \(T{T_2} \to T{T_3}\): quá trình đẳng nhiệt, ta có:
\(\left\{ \begin{array}{l}{p_2}{V_2} = {p_3}{V_3}\,\\{p_2} > {p_3}\end{array} \right. \Rightarrow {V_2} < {V_3}\)→ dãn đẳng nhiệt
Cho đồ thị biến đổi trạng thái của một khí lí tưởng từ (1) đến (2) như hình vẽ. Tỉ số \(\dfrac{{{T_1}}}{{{T_2}}}\) bằng:

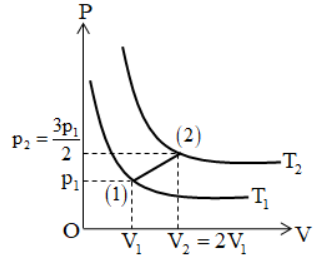
Áp dụng phương trình trạng thái của khí lí tưởng ta có:
\(\dfrac{{{p_1}{V_1}}}{{{T_1}}} = \dfrac{{{p_2}{V_2}}}{{{T_2}}} \Leftrightarrow \dfrac{{{p_1}{V_1}}}{{{T_1}}} = \dfrac{{\dfrac{3}{2}{p_1}.2{V_1}}}{{{T_2}}} \Rightarrow \dfrac{{{T_1}}}{{{T_2}}} = \dfrac{1}{3}\)
Tính khối lượng riêng của không khí ở 1000C và áp suất 2.105Pa. Biết khối lượng riêng của không khí ở 00C và 1,01.105 Pa là 1,29 kg/m3.
Thể tích của 1kg không khí ở điều kiện tiêu chuẩn : \(D = \dfrac{m}{V} \Rightarrow V = \dfrac{m}{D}\)
\(TT1:\left\{ \begin{array}{l}{p_0} = 1,{01.10^5}Pa\\{V_0} = 0,78{m^3}\\{T_0} = 273K\end{array} \right. \to TT2:\left\{ \begin{array}{l}{p_2} = {2.10^5}Pa\\V = ?\\{T_2} = 100 + 273 = 373K\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lí tưởng ta có:
\(\dfrac{{{p_0}.{V_0}}}{{{T_0}}} = \dfrac{{p.V}}{T} \Rightarrow V = \dfrac{{{p_0}.{V_0}.T}}{{p.{T_0}}} = \dfrac{{1,{{01.10}^5}.0,78.373}}{{{{2.10}^5}.273}} = 0,54{m^3}\)
→ Khối lượng riêng của không khí ở 1000C là:
\(D = \dfrac{m}{V} = \dfrac{1}{{0,54}} = 1,85kg/{m^3}\)
Một lượng khí có thể tích 250cm3 ở nhiệt độ 170C và áp suất 740mmHg. Thể tích của lượng khí này ở điều kiện chuẩn là :
Xét lượng khí xác định trong phòng thí nghiệm:
\(TT1:\left\{ \begin{array}{l}{p_1} = 740mmHg\\{V_1} = 250c{m^3}\\{T_1} = 17 + 273 = 290K\end{array} \right. \to TT2\,\left( {dktc} \right):\left\{ \begin{array}{l}{p_2} = 760mmHg\\{V_2} = ?\\{T_2} = 0 + 273 = 273K\end{array} \right.\)
Áp dụng phương trình trạng thái của khí lí tưởng ta có:
\(\dfrac{{{p_1}.{V_1}}}{{{T_1}}} = \dfrac{{{p_2}.{V_2}}}{{{T_2}}} \Rightarrow {V_2} = \dfrac{{{p_1}.{V_1}.{T_2}}}{{{p_2}.{T_1}}} = \dfrac{{740.250.273}}{{760.290}} = 229,15c{m^3}\)

